距离A level的十月大考已经很近了。在AS阶段的化学考试中,“定义题”是其中最为简单,但相比难度而言,得分率却没有那么高的一种题型。
接下来,就跟随老师的步伐,将化学AS阶段的几个最为重要的定义加以复习一下吧。
1、First ionisation energy第一电离能
The energy needed to remove one electron from each atom in one mole of the element in the gaseous state to form one mole of gaseous 1+ ions.
1摩尔某元素的气态原子,各失去1个电子,生成1摩尔一价气态正离子所需要的能量。
第一电离能是原子结构部分,最容易因为细节缺失,而不能拿到完整分数的定义题。其中「1 mole」「1+ ion」「gaseous」几个点缺一不可。这是因为,在热化学方程式中,系数会影响能量的计量,而物态变化会导致能量变化。所以,本定义的另一种常见考法,是写出能表示某元素第一电离能的表达式。那么我们则必须使原子和一价正离子的系数都为1,且注明物态为g (gaseous,气态)。
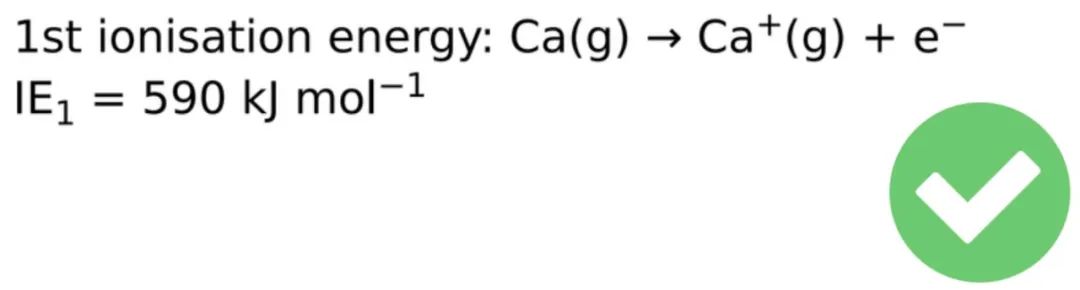
2、Unified atomic mass unit原子质量单位
The mass of one twelfth of the mass of a C-12 atom.
C-12原子质量的十二分之一。
原子的质量非常小,因此需要定义一个很小的质量单位。C-12原子含有6个质子、6个中子和6个电子,其质量的1/12“可以说”“大致上”是质子和中子在某种程度上的平均质量,从而非常适合体现原子(特别是原子核)的质量。
原子质量单位是相对简单,但考查概率仍然较大的定义。本定义的一个常见考法,是在后面跟上一个「Define relative atomic mass in the term of unified atomic/isotopic mass unit」。
3、Relative atomic mass相对原子质量
Weighted average mass of the isotopes of the atom(s) of an element compared to the unified atomic mass unit.
一个元素的全部同位素相对于原子质量单位的质量的加权平均数。
Relative atomic mass经常和relative isotopic mass做辨析。这里需要注意两者的主体不同,相对「原子」质量针对某一元素,是某一元素所有同位素的相对质量的加权平均;而相对「同位素」质量则针对某一原子,是某一种特定的原子的相对质量。因此,我们可以说Ga的相对原子质量是69.723,而说Ga-69的相对同位素质量是68.926。

4、Electronegativity 电负性Power of an atom to attract electrons to itself.原子吸引电子的能力。
Electronegativity的定义考起来比较简单,但它的应用却非常广泛。首先,我们需要了解最常用的几种元素的电负性顺序:
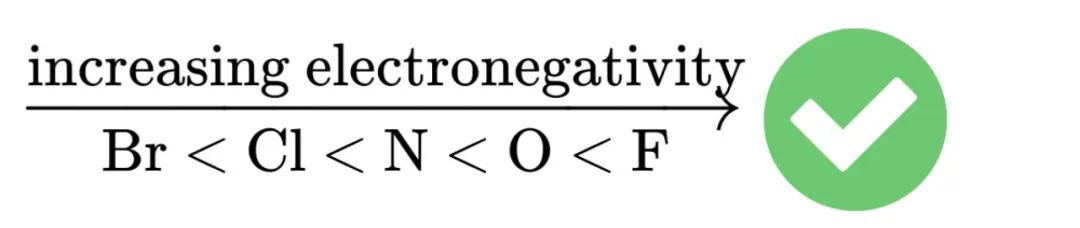
其次,我们需要了解,在元素周期表中,右上角元素电负性高,左下角元素电负性低的基本趋势。这有助于我们凭「感觉」判断化学键的极性和整个分子的极性。在A2阶段,这还有助于我们凭「感觉」判断某个物质更适合做氧化剂或者还原剂。
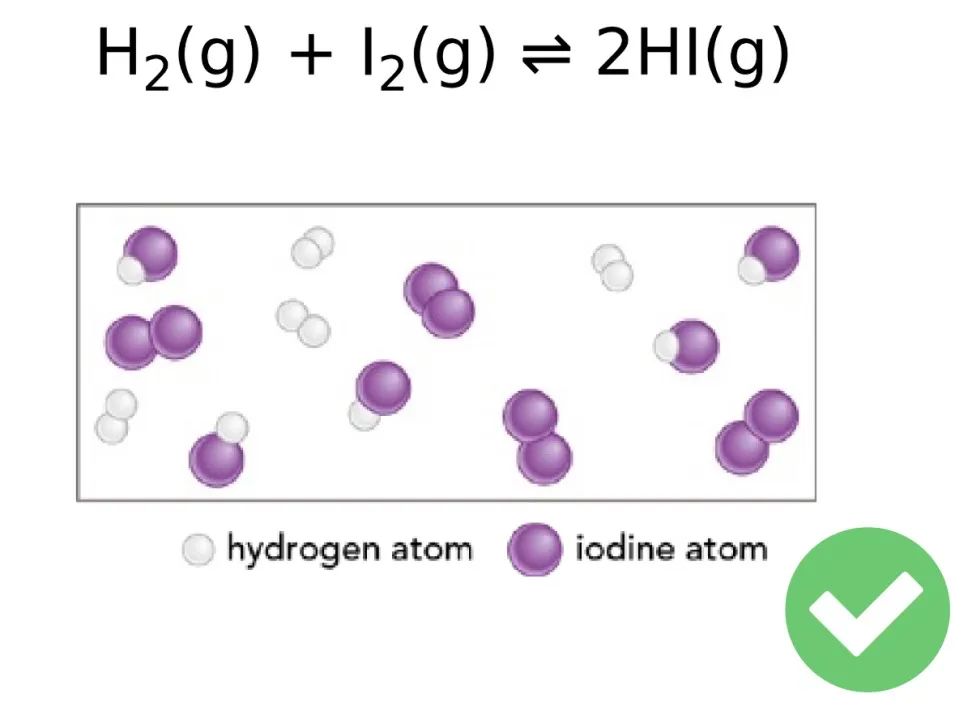
5、Dynamic equilibrium 动态平衡
Dynamic equilibrium means that the molecules or ions of reactants and products are continuously reacting. Reactants are continuously being changed to products and products are continuously being changed back to reactants at the same rate.
动态平衡,意味着反应物和产物在持续地相互转化,且相互转化的速率相等。
动态平衡意味着所有反应物和所有产物的浓度,在一段时间内不发生改变——这绝不意味着他们的浓度相等(2023年了,还是有同学会这么误认)。相应地,他们的浓度会满足平衡常数的表达式。
微观上,动态平衡中的「动态」,则强调化学反应的正反应和逆反应都在持续进行。这意味着处于动态平衡中的反应体系并不是一潭死水,而是仍然在不断进行着化学反应。
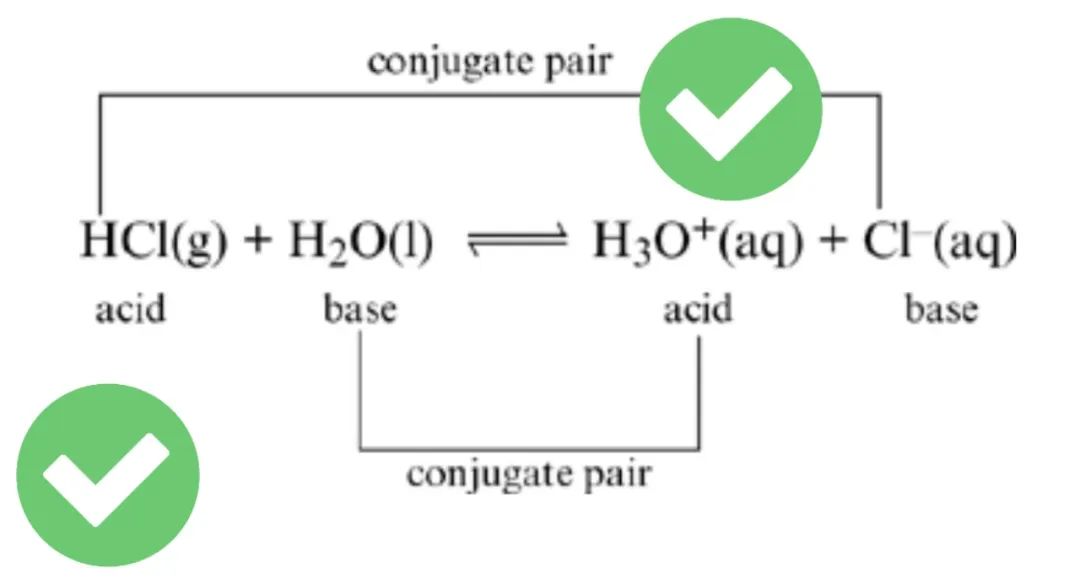
6、Bronsted-Lowry acid质子理论的酸
Proton donor.
质子供体。
在Bronsted-Lowry theory (酸碱质子理论) 中,酸碱反应被理解为质子转移。因此在这一理论中,质子供体被定义为酸,质子受体被定义为碱。在完成酸碱反应后,酸给出质子,成为其共轭碱(conjugated base);碱得到质子,成为其共轭酸(conjugated acid)。判断酸碱反应能否自发进行完全的一个重要标准,就是看反应前的acid,是否强于反应后生成的conjugated acid。H3O+是一种重要的标的物,比其更强的酸,就称为强酸。(上述表述也可以带入碱的视角,读者可自行尝试阐述。)
7、Enthalpy change of neutralisation中和热
Enthalpy change when 1 mole of water is formed from an aqueous acid and an aqueous base.
水溶液中的酸和碱反应生成1摩尔水的能量变化。
凡是化学反应的热效应都要强调物质的量和物态,这是老生常谈。在中和热中,还需要额外强调的是,测量中和热的反应不可以嵌套其他反应,例如沉淀反应和电离反应。
8、Enthalpy change of formation 生成焓
Enthalpy change when one mole of a compound is formed from its elements in their standard states.
从标准态单质,生成1摩尔某化合物的能量变化。
凡是化学反应的热效应都要强调物质的量和物态,这是老生常谈(重说二)。在生成焓这里,格外需要强调的有:标准态单质的生成焓为0(但非标准态单质,例如液态氧,则不为0);生成焓只强调反应物必须为标准态单质,而生成物则可以为任何物态(只不过,不同物态的同一生成物生成焓不同,在使用时不可以混用)。

9、Enthalpy change of combustion 燃烧热
Enthalpy change when 1 mole of a compound completely burns in oxygen.
一摩尔物质,在氧气中完全燃烧所产生的能量变化。
凡是化学反应的热效应都要强调物质的量和物态,这是老生常谈(重说三)。在燃烧热中,我们需要知道,所谓的完全燃烧,指的是生成CO2(g),SO2(g),N2(g),H2O(l)这样的所谓「标准氧化物」。由于对于所谓标准氧化物,各方定义颇有争议(例如C的标准氧化物是最高价态IV价,但S的标准氧化物则是非最高价态IV价,而N的标准氧化物居然是0价),所以燃烧热本身的严谨性并不如生成焓,在使用的时候还是注意观察具体的化学方程式为好。

大考在即,还有疑惑没有得到解答吗?