有机化学中的亲核取代反应机理
Organic Chemistry:Nucleophilic Substitution Mechanism
以卤代烷烃halogenoalkanes为例:
✅ 实验1:溴甲烷与碱水溶液发生水解取代反应时,反应速率与溴甲烷和碱两者的浓度都成正比。
✅ 实验2:叔丁基溴与极性溶剂(如水H2O)发生取代反应时,反应速率却仅与叔丁基溴的浓度成正比。
01、这是为什么呢?
这与反应速率控制步骤(速控步)相关。关于饱和碳原子上的亲核取代反应,通常有两种反应机理:双分子亲核取代反应机理(TheSN2 Mechanism)和单分子亲核取代反应机理(The SN1 Mechanism)
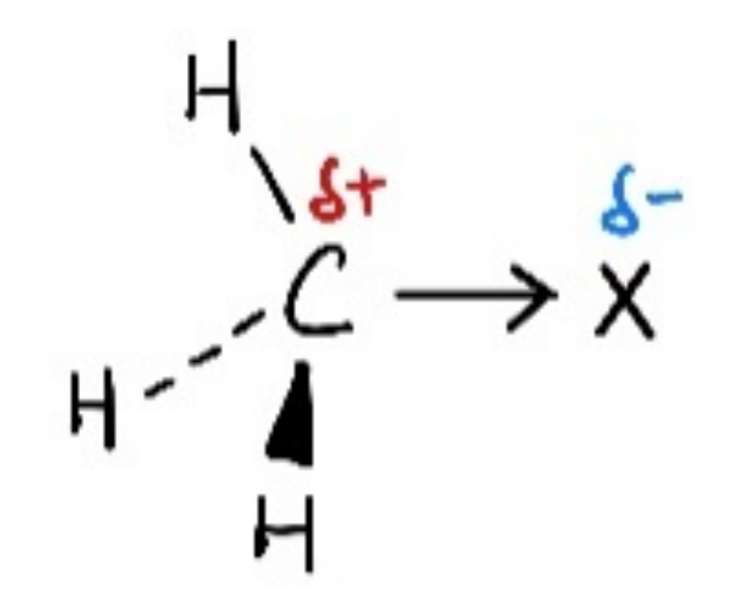
The halogen is more electronegative than carbon. Sothe carbon-halogen bond is polarized.
02、实验1
对于溴甲烷这个
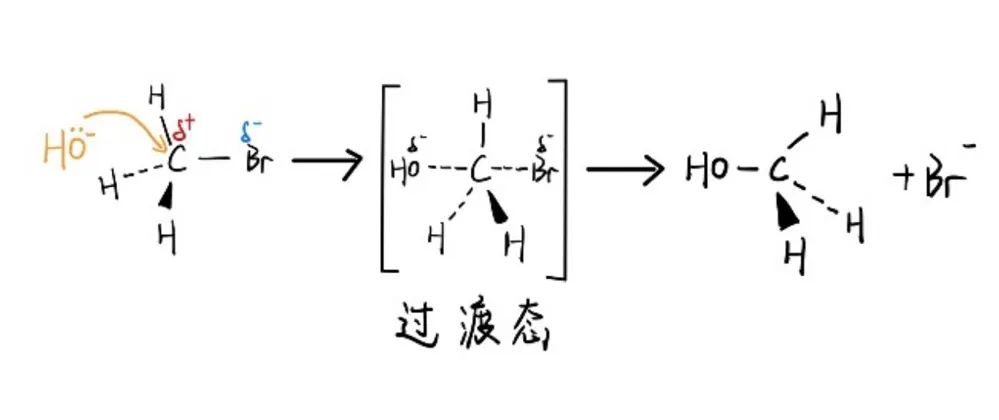
伯卤代烷(primary halogenoalkanes),当离去基团溴原子离开中心碳原子的同时,亲核试剂OH-也与中心碳原子发生了部分的键合。
因此键的断裂与键的形成同时发生,中间有一个过渡态,体系能量达到最高。
整个反应过程一步完成,反应速率与溴甲烷和碱两者的浓度都成正比,即双分子亲核取代反应机理(TheSN2 Mechanism)。
立体化学特征:
发生双分子亲核取代时,亲核试剂是从离去基团的背面进攻中心碳原子,原因是此方向进攻受离去基团的电子效应和空间效应的影响最小,需要的能量最低,最易发生。
因此,对于中心碳原子是手性碳原子的情况,构型会发生反转,即Walden转化。
03、实验2
对于叔丁基溴这个
叔卤代烷(tertiaryhalogenoalkanes),反应分三步进行:
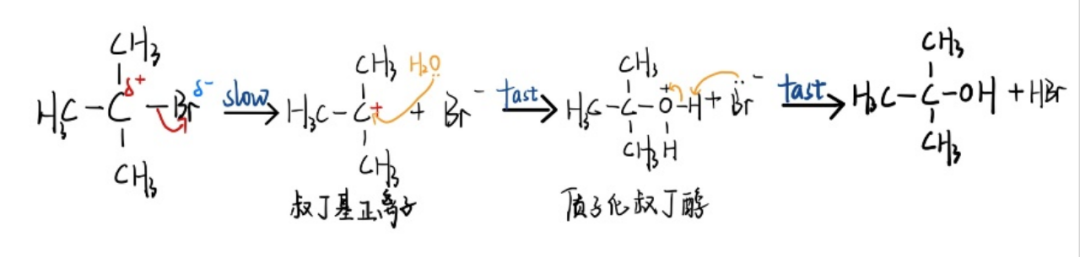
✅ 第一步,叔丁基溴在溶剂中成键电子对偏向溴原子后解离生成溴离子和叔丁基正离子(能量较高的活性中间体),反应所需能量高故速度慢即为决定该反应速率的速控步。
✅第二步,叔丁基正离子与水H2O亲核试剂快速结合,生成质子化叔丁醇。
✅第三步,质子化叔丁醇快速将质子转移,获得产物。此过程速控步反应速率仅与叔丁基溴相关,即单分子亲核取代反应机理(The SN1 Mechanism)。
立体化学特征:
发生单分子亲核取代时,由于反应的活性中间体为碳正离子,中心碳原子平面构型为sp2杂化。亲核试剂与之反应时,可从平面的两侧进攻中心碳原子。
因此,对于中心碳原子是手性碳原子的情况,所得产物是由两种构型相反的化合物组成的外消旋混合物。碳正离子还常常伴随着重排反应的产生。
一般来说,
仲卤代烷烃(secondary halogenoalkanes)两种机制都可能发生,取决于实际的卤代烃和反应条件。并且,大多数亲核取代反应往往介于两种反应之间,并没有绝对的SN2 反应和SN1 反应,外消旋化的同时也伴随着构型反转。