2024年AP化学考试即将到来,同学们有在搓手手,冲刺行动起来了吗?这篇文章将为你提供最重要的两份助力资料:
一.考前实用嘱咐
二.分章易错点总结
其中第二份资料,由东晨老师根据大家在复习阶段的种种提问,把同学们刷题后发现的“疑难杂症”提炼到极致,浓缩为55个易错知识点,认真读上55分钟,你就能获得刷题一个月的精华心得!
{ 一.考前实用嘱咐 }
1. 考试工具:
一支HB / 2H / NO.2铅笔和一块橡皮,用来填涂选择题答题卡✍️
一支黑色签字笔,用来写问答题和卷子封面信息✍️
一台科学计算器,注意要能进行指数(exponent)和对数(logarithm)运算,能把计算结果由分数转换成小数,关掉声音,确保电池充足🔋注意选择题和问答题两部分都可以使用计算器。
2. 题目数量与时间把控:
选择题:
一共有60道题,给定作答时长90分钟,卷子中会提供元素周期表、公式表和常用常数值。每道题用时应不超过1分半。建议边做边涂答题卡。遇到纠结的题目、或感觉计算量巨大的题目,可以先空着不涂,在答题卡的题号上画个标记。
第一轮先快速选好有把握的题目,后续有时间再纠结迟疑的题目。特别注意,选择题难度不是递增的,偶尔还喜欢把难题放在开头搞心态,同学们切忌因为纠结于某几道题,耽误了全局。前半截空了比较多题目时,心态要稳,后面的题目也许会更简单,甚至做后面的题目也会启发前面的解题思路。
问答题:共有3道长问答和4道短问答题,给定作答时长105分钟。卷子中会再次提供元素周期表、公式表和常用常数值。长问答要特别注意把小问做全,一道题有个abcdefgh……小问都很正常,注意把卷子翻到底,千万不要漏小问。某一小问卡住了也不要慌,后面某部分补充了新条件后,后续小问的难度还会降低,即使前面空了几问,后面的小问依旧有做出来的机会。
自己在答题纸上写作答过程时,把小问编号标清楚,如果某一小问经过了很多计算和分析步骤,记得把最终结果画个框框或下划线强调一下,方便答后面的小问时再查询使用前面小问的计算结果。切勿在长问答上浪费过多时间,前三道长问答题只用一小时完成,一小时后即使没做完,也要开始做短问答,可以在卷子封面内页,把长问答空着没做的题号和小问记一下,免得后续有时间想补的时候找不到。短问答不会层层递进很多小问,反而更容易拿分。问答题中回答计算题时,最好先把使用到的公式写一遍,万一后面运算出错,至少还有个步骤分。实在没思路时,也可以把感觉相关的公式写上,也许再往后做一做,就找到灵感了。
{ 二.分章易错点总结 }
Chp. 1: Atomic Structure & Periodicity
1.电子跃迁(electron transition)时吸收或释放的光为紫外或可见光(ultraviolet orvisible light)。光能的大小可以通过吸收或释放的光的频率(frequency)计算:
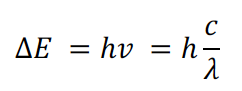

最近几年非常爱考原子发射光谱图(atomic emission spectrometry),这个图像的分析也是基于上述公式中的变量关系,注意读图时辨认下横轴波长(wavelength)到底时向左递增,还是向右递增,这类图像的横轴递增方向并不固定。
2. 审题时注意看题目让你写的是原子全部电子的electron configuration,还是只写valence electron的部分。分析价电子时,要注意区别对待不同区(block)的元素:


3. 使用库伦定律(Coulomb’s Law)分析电离能(ionization energy)大小时:
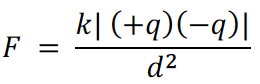
其中“ k ”为固定常数,“ +q ”指正电荷数,这里对应原子核内的质子数,“ -q ”指负电荷数,这里对应一个电子的负电荷数,即-1,“ d ”指正负电荷间的距离,这里对应电子所在层数。解释同周期元素电离能差异时,应主要分析原子核内质子数的影响;解释同族元素电离能差异时,应主要分析电子层数不同导致的正负电荷距离差异。
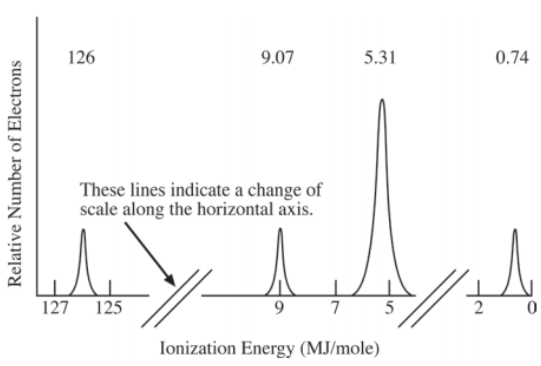
4.周期表中原子的电离能(ionization energy)沿着从左下到右上的方向递增。只可能由外往内依次移走电子,移走后一个电子总是要比移走前一个电子付出更大电离能,跨主层移走电子时,电离能会陡增(big jump)。另外考试也要求大家能通过photoelectron spectra判断元素类型。这类图像的横轴常见为电离能或者结合能(binding energy),注意越往左边代表更高能的内层电子,越往右边代表更低能的外层电子,纵轴高度代表处于这个能量轨道的电子数量。例如下图是镁原子的光电子图谱。
5. 元素的电负性(electronegativity)也会在周期表中沿着从左下到右上的方向递增,但要注意两处例外,一是H元素的电负性约等于P元素,所以要把它放到P的位置去与其它元素的电负性比大小;二是大多数d-block的过渡金属(transition metals)元素并不符合这个规则。考试时给的周期表没有半金属分界线,同学们需要自己记住B、Si、Ge、As、Sb、Te、Po、At这条分界线。元素的电负性与其非金属性正相关,当然也与其金属性负相关。
Chp. 2: Intramolecular and Intermolecular Forces
6.使用库仑定律定律分析离子键强弱时:
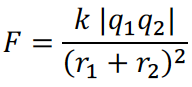
优先考虑阴、阳离子电荷乘积的影响,当电荷乘积相同时,再比较离子半径之和的影响。注意离子化合物固态不导电,熔化或溶于水后才能导电,是三大类物质里唯一导电性会随相态剧烈变化的。
7.分析物质的熔沸点相对高低时,最高的往往是network covalent compound,其次找ionic compounds,再其次找metals,最后分析普通covalent compounds。分析离子和金属单质的熔沸点时要依据分子内作用力的强弱去判断,而分析普通共价化合物的熔沸点时要依据分子间作用力判断。
分析分子间作用力对物质熔沸点影响时,先看电子云大小差异,如果电子云size差异不大,优先分析力的类型,有hydrogen bond(HB)的物质往往三种力都有了,熔沸点最高;最强只有dipole-dipole force (DDF) 的物质往往缺少HB,熔沸点次高;有且只有London dispersion force (LDF)的物质往往熔沸点最低。
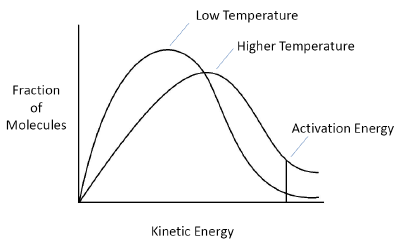
氢键出现的条件最苛刻,要满足两条:一是必须在极性分子之间,二是极性分子内部有H原子与N / O / F /任一原子之间相连,特别注意有机物中罕见的有HB的官能团:-OH, -COOH, -NH2。
DDF的强弱与分子的net dipole moment成正相关,LDF的强弱与分子的size or polarizibility of electron cloud成正相关。电子云大小可以具体分析,它与分子的电子总数和原子核总数成正相关。这部分手写总结可以参考下图:
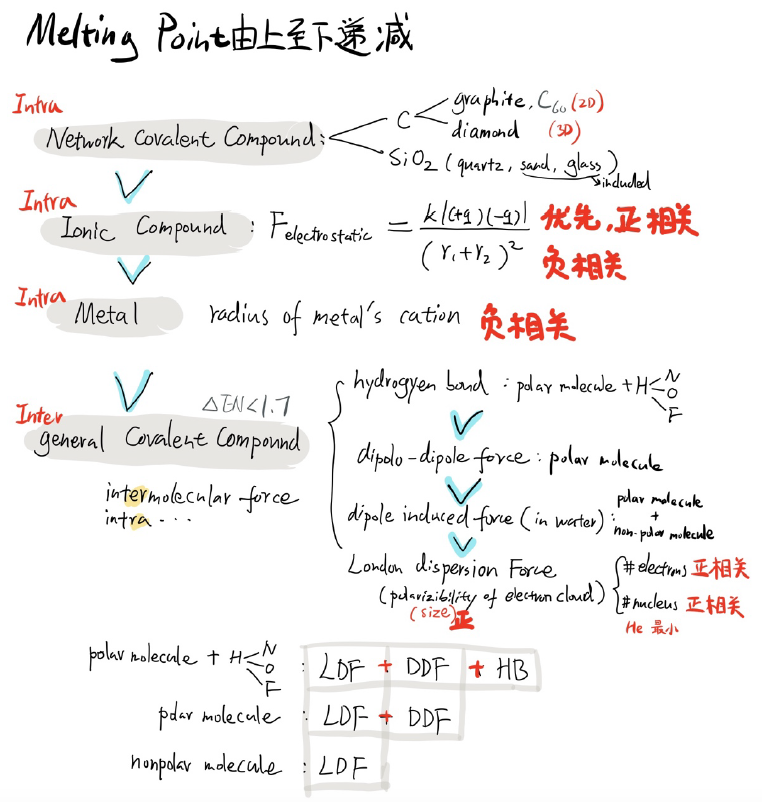
注意问答题中,第一次写分子间作用力时要写全拼,后面还要继续表述时,可在全拼后面写上括号与首字母缩写,然后再反复使用缩写指代。
8.分析原子间的共价键键长(bond length / intramolecular distance)时,要先看原子周期,周期越大,电子层数越厚,导致原子半径更大,键长更长。若原子周期相同,则要进一步分析键的条数,键的条数越多,则键极更大,键能更高,键长更短。
9. 分析共价化合物的分子形状或键角时,千万不要被Lewis structure迷惑,平面图画了十字形,但立体空间中却是正四面体结构!键角是109.5°。
sp hybridization周边全是单键的话键角是180°,形状是linear;sp2 hybridization周边全是单键的话键角是120°,形状是trigonal planar;sp3 hybridization周边全是单键的话键角是109.5°,形状是tetrahedral。这几个经典易构成nonpolar molecule的键角和形状一定要熟记,在此基础上,中心原子周边每多一个lone pair,键角就会减少2.5°。
注意linear,bent,trigonal planar,square planar,T- shaped 这些分子构型的所有原子都在同一平面;而tetrahedral,trigonal pyramidal,trigonal bipyramid,seesaw,octahedral,square pyramidal这些分子构型的所有原子分布在不同平面,都是三维立体构型。
10. 分析polarity of bond时要看键两端原子electronegativity的差异,差异越大,键的极性越大。考试中很少直接给出元素的electronegativity,但我们可以观察元素在周期表中的位置去分析——主族元素沿着从左下到右上方向距离越远,意味着electronegativity差异越大,特别小心把H原子放到P原子的位置去分析。
Chp. 3: Stoichiometry and Reaction Equation
11.在问答题计算中,注意运算结果保留的精确位数,应与题干中测量值的最粗糙(精确位数最少)的值保持一致,特别注意公式中的常数,和反应方程式中的系数是无穷有效的,有它们参与的运算时,并不会使计算结果更粗糙。
12. 书写净离子方程式(net ionic equation)时,特别注意弱酸、弱碱虽然状态写着“(aq)”但是不能被拆分成离子,它们大多数还是会逆向生成分子的状态。
Chp. 4: Phase Change and Gas
13. 题目没有特别强调反应温度有变化时,往往默认温度不变,可以使用Graham’s Law:在同一温度下,不同气体分子平均动能相同,但扩散速率与分子质量的成负相关,可写作公式:
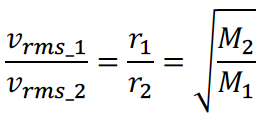
这种负相关关系也可以用Maxwell distribution的图像来考查,例如下图。
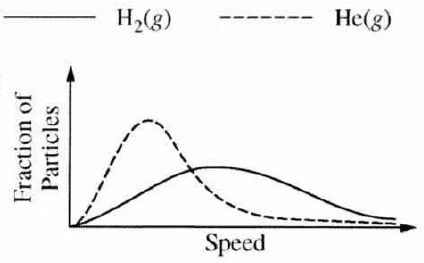
14. 根据KMT,气体在高温、低压的环境下,表现最接近理想气体。环境条件不变时,真实气体自身的分子间作用力越弱(非极性分子且电子数越小,原子核个数越少),摩尔质量越小时,该真实气体越接近理想气体状态,例如在同样的温度和压力下,氦气(Helium gas)是常见真实气体中表现最接近理想气体的。理想气体的各项特征变量符合下列计算公式:

15. 同样温度与压力下,气体的密度与摩尔质量成正比。当分析气体密度相较于空气密度的大小时,可以把空气的摩尔质量约取作29 g/mol,然后把任一气体摩尔质量与29做对比,大于的即密度也大于空气,适合用向上排气法收集;小于的即密度也小于空气,适合用向下排气法收集。
16.物质的分子间作用力与其平衡蒸汽压(vapor pressure)成负相关,但与沸点成正相关。
Chp. 5: Solution
17.使用相似相溶原理(like dissolves like)时,注意solvent和solute的分子极性都要分析,例如溶质和溶剂分子都是非极性(nonpolar)分子或者两者都是极性(polar)分子时,溶质的溶解度会较高;而两者一个是极性分子,另一个是非极性分子时,溶质的溶解度会较低,彼此间存在微弱的偶极矩间诱导力(dipole-induced force)。
18.多数固体或液体溶质的溶解度与温度正相关,而气体溶质的溶解度与温度负相关。只有气体溶质的溶解度会受压强影响,且两者呈正相关。
19.注意写难溶盐的溶解方程式时,符号要写“⇌”。
Chp. 6: Kinetics
20.反应速率常用单位是“ molarity per second ”,也可简写作
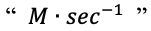
其与各参与物在化学方程式中的系数(coefficient)成正比,题目问哪个物质能测出最大rate时,不用计算order,只要找系数最大的物质即可。
21.在问答题中,使用实验法比较多组数据测定rate order前,应先假设Rate law ,比如有多个反应物参与的化学反应:
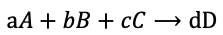
可设Rate law为

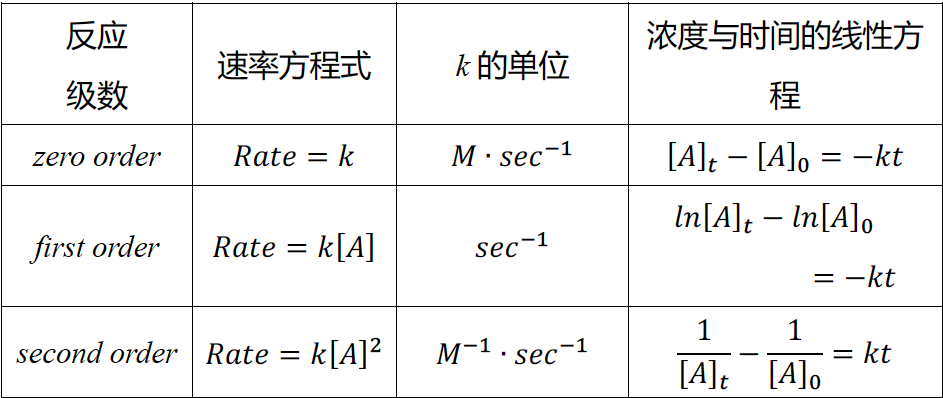
22.零、一、二级反应的速率方程式及相关线性关系式总结

23.半衰期(half-life)计算公式

24.核衰变(nuclear decay)反应是典型的一级反应,只有一级反应的半衰期是固定不变的,计算一级反应的半衰期简便公式:
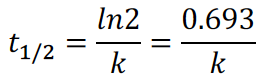

25.零、一、二级反应的图像总结
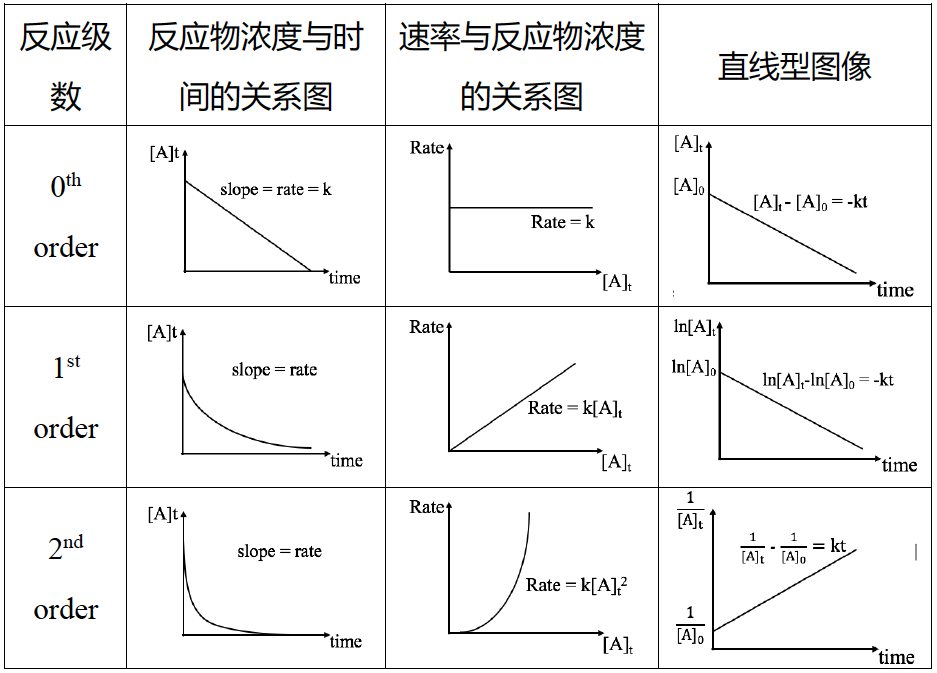
一级反应的反应物浓度相对于时间的图像成-ln 函数,二级反应的反应物浓度相对于时间的图像成反比例函数。其曲率并不相同。
26.反应的焓变(change of enthalpy)可以通过正、逆方向的活化能(activation energy, Ea)差值计算,公式为:
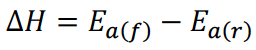

27. 多步反应的总势能变化图会呈多次先升后降的趋势,曲线有几次peak,就对应反应有几个分步。可以比较不同分步的Ea 大小,来看分步的相对快慢,注意Ea 永远与Rate 成负相关。多步反应的总速率约等于其中最慢速的单步反应的速率,而且slow-determining step是一步到位的elementary rxn,可以照着方程式,系数做指数,直接写rate law。
中间产物(intermediate)是同时作为上一步反应的产物和下一步反应的反应物的物质,在总方程式中能被约掉。催化剂(catalyst)作为反应条件经常,也常作为第一步单步反应的反应物,在总方程式中不能被约掉,反应前后会保持不变,一直出现在反应前后。
28. 分析反应物浓度对速率的影响时,要先看rate law,如果rate law显示分析对象order为零,则其浓度对速率没有影响,order大于或等于1,或者原题没给出rate law时,反应物浓度才会与速率成正相关。
29. 温度升高使分子能量普遍增大,使达到Ea要求的分子占总分子比更大,也使得分子碰撞频次(frequency)增多,它对于molecular collision有能量和频次两种影响方式。温度与分子动能的关系同样可以用这种概率分布图去表达。
Chp. 7: Equilibrium
30.题目没有特别说明反应已达到平衡,那给的现成条件就都是初始条件。若以初始浓度作为衡量物质的量,反应商值(quotient)可通过该公式计算:
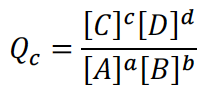
若以初始分压作为衡量物质的量的单位时,反应商值可通过类似的运算机制计算。Qc与Kc的比较,或者Qp与Kp的比较,可用来判断反应接下来会按哪个方向进行,从而达到平衡。

31.使用勒夏特列定律(LeChatelier' s Law)时,特别注意若题目要求的最终效果是升高或降低某物质浓度,则选用的方式不能是直接改变该物质本身浓度。往反应容器中充入 noble gas 或者某种不与反应参与物反应的气体,不会对反应造成影响。
反应前后气体摩尔数之和相等、或没有气体参与反应时,改变压力也不会影响反应。分析改变温度对平衡的影响时,要注意反应到底哪个方向是吸热,哪个是放热方向。反应不变时,只有温度变化能够改变平衡常数的大小。
32.书写平衡常数表达式时,不要把相态是solid或liquid的物质浓度写进去,若反应物或产物只有solid或liquid,那就是对应的分子或分母取1M代入运算。
33.工业制备氨气的理想方法(Haber Process)中高压和过量氮气都促进了反应正向进行,但高温会促进反应逆向进行却有利高速反应。催化剂不影响平衡进程。
Chp. 8: Thermodynamics
34.

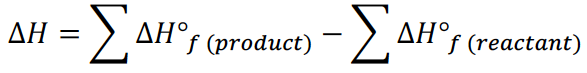

用键能改变累积计算焓变的公式为:
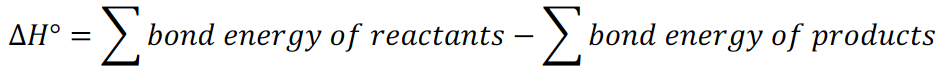
当一个分子含有多条化学键,我们需要把题目给出的每摩尔键能既乘以方程式中的系数,又乘以每个分子包含的这类键的数量。
35.比热容可以表示改变每一克物质,使其变化一摄氏度温度时所需的热量,常用符号“ c ”表达,其单位是 J/(g∙°C),相关计算公式为
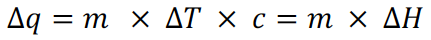
这个式子里∆H的单位是 J/g ;比热容还可以表示改变每一摩尔物质一摄氏度时所需的热量,相应单位是 J/(mol∙°C),相关计算公式为
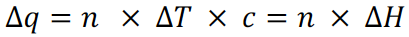
这个式子里∆H的单位是 J/mol,注意分析反应的molar enthalpy change时,要相对于限量反应物或产物的摩尔数计算。
36.


37.∆G 如何受ΔH 、ΔS 、温度的影响,可通过下列公式判断:

在同一状态下,三种能量的变化值都可以通过该公式进行定量计算,或判断正负值。计算时要特别注意统一单位,也要看清题目要求结算结果单位取J / mol_rxn还是kJ / mol_rxn,其中温度单位常取K 。
例如当∆H和∆S的值一正一负时,∆G正负固定,不受温度变化影响:
- ∆H<0,∆S>0 对应放热且熵增的反应,在任何温度下都可以自发进行(thermodynamically favorable),即∆G<0;-∆H>0,∆S<0 对应吸热且熵减的反应,在任何温度下都无法自发进行(thermodynamically unfavorable),即∆G>0;
当∆H和∆S的值同正或同负时,∆G正负不定,受温度变化影响变化:
-温度不断升高时,随着T的影响力渐增,∆G=∆H-T∆S≈0-T∆S,∆G的正负由∆S决定,永远与∆S正负相反,不受∆H影响;-温度不断降低时,随着T的影响力减弱,∆G=∆H-T∆S≈∆H-0,∆G的正负由∆H决定,永远与∆H正负一致,不受∆S影响。
Chp. 9: Acid and Base
38. 分析缓冲溶液(buffer solution)的成分时,除了常见的弱酸溶液与含有其共轭碱的碱性盐、 或者弱碱与含有其共轭酸的酸性盐这两种组合;也要注意酸碱中和反应中,弱酸或弱碱有剩余时,也可以与中和生成的盐构成缓冲溶液,所以做题时要注意分析物质的量。另外滴定试验中,用强碱滴定弱酸,或用强酸滴定弱碱,都会在起点之后,等当点之前生成缓冲溶液,使得溶液pH值变化缓慢,不是不变。
39. 在滴定曲线中寻找半等当点时,要先通过titration jump找到滴定液的恰当量对应的横轴值,把这个横轴截距取一半长度,对应的曲线上的点就是半等当点,此时若成份是剩余弱酸和碱性盐,则pH = pKa;若成份是剩余的弱碱和弱性盐,则pOH = pKb。
40.

41.

一对共轭酸碱中,若酸是弱酸,则其共轭碱有机会发生逆反应,成为真正的Lewis碱,碱性强弱与其共轭酸的酸性强弱成负相关,换作弱碱与其共轭酸也是同理,共轭对中弱酸与弱碱的酸碱性永远此消彼长。
42.

Chp. 10: Redox Rxn and Electrochemistry
43.计算电池电压的公式是:
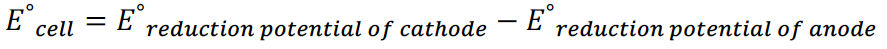
使用这个公式时,不用考虑方程式中物质的系数。
做问答题时,要特别注意关于电池类型、功能(是support energy,还是plates metal)的信息,先确定电池类型,后根据下表总结的方法,寻找其cathode。

判断电解池装置中的启动电源方向时,注意一长一短线的示意画法中,短线的一端往往是电子流出端,会连接到cathode;而画一个带凸点的圆柱体电池时,平底(或凹陷)的一端才是电子流出的那端。
44.书写半反应方程式时,只要注意每个半反应方程式内原子个数守恒,电荷守恒,系数化到最简即可,不用与总式子系数保持一致。得电子时,把电子写在反应式左边,作为反应物;失电子时,把电子写在反应式右边,作为产物。
45.电量、电流、电子摩尔数之间的关系(relationship between charge, current and number of mole of electron)
-单位时间内转移电子携带电量(charge)可通过该公式计算:

-单位时间内通过固定横截面导体的电量,还可以表达为电流(current),计算公式为
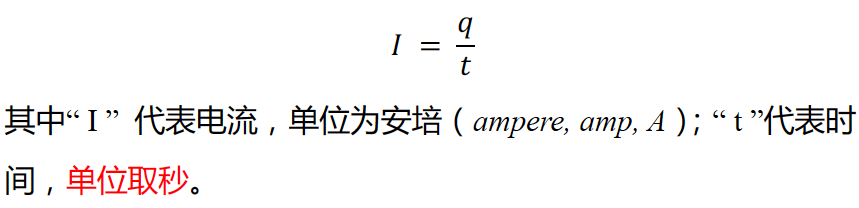
46.标准电池的自由能变化值与电压的关系(relationship between ∆G^°and voltage of standardcell)
标准电池的标准吉布斯自由能变化值,永远与电压值正负相反,彼此间的计算关系可参考如下公式:
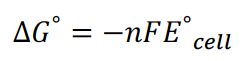
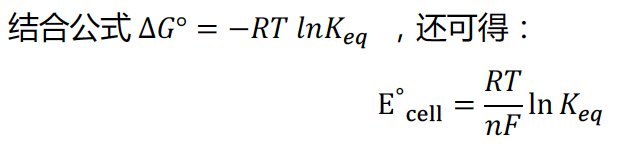

47. 非标准电池的电压变化分析
题干一旦改变了反应参与物的浓度,使其离子或气体浓度不再为1M,或者温度不再是298K,或者压力不再是1 atm,都会使电池变成非标准电池,其电压计算可参考公式:
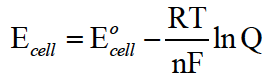

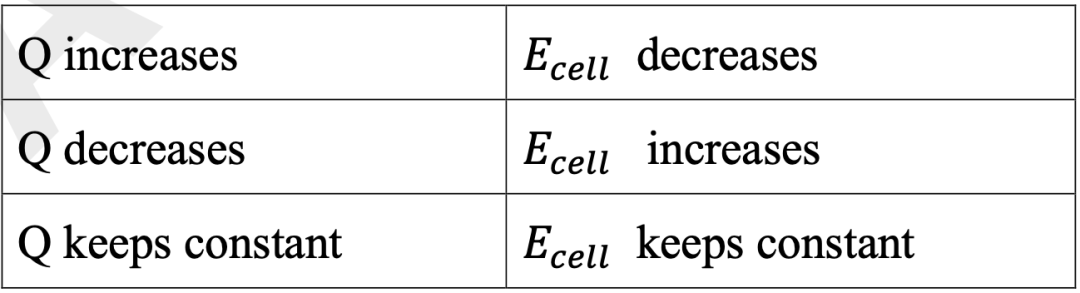
分析非标准电池电压,相比于原来发生怎样的变化时,可参考下列关系:
48. 盐桥(salt bridge)的设计与安装
原电池(galvanic cell)的盐桥应选择不与两端电极物质反应,且呈水溶离子态(aqueous ions)的离子化合物作为理想填充材料,管道两端用琼脂(agar)或导电凝胶(electric gel)封口,这样才能任其中的阳离子(cation)向电池阳极(cathode)移动,阴离子(anion)向电池阴极(anode)移动,从而持续中和电性(neutralize charge)。如果把盐桥代替成金属导线,则会使电池停止运转,电压归零。
Chp. 11: Laboratory Chemistry
49. 读取测量仪器的度数时,一定要比仪器刻度多估读一位,滴定管往往越往上刻度值越小,往下可读值越大。由读取仪器测算出来的值才是measured value,而通过公式推导出来的值都是theoretical value。
50. 玻璃细管(尤其注意滴定管)中的液面会有一个弯月面,读取读数时,应使视线与弧形最低凹陷处的水平切线齐平。
51. 稀释溶液,或进行酸碱滴定操作时,不要用量筒,溶液可能会腐蚀刻度,而且放热过程中可能会伴随热液溅出😱,应尽量选择“小口大肚”的Erlenmeyer flask。量瓶(volumetric flask)瓶口附近只有一个刻度,最好选择其唯一刻度体积,最接近你想稀释达到的最终体积的量瓶,添加蒸馏水时,前面可以分多次添加,最后接近目标刻度线时,用滴管(dropper)逐滴添加。
52. 过滤法(filtration)常用于分离固态和液态混合物,操作中引流用的玻璃棒(glass rod)应靠着滤纸(filtration paper),液态物质会被分离成为滤液(filtrate),固态物质会被分离成为滤渣(residue)。称量滤渣质量前,应反复冲洗并将其尽可能干燥,一直干燥到前后质量变化值,小于最小有效位数时。
53. 使用分光光谱仪(spectrophotometer)时,可以根据朗伯比尔定律(Beer-Lambert’s law)分析,它描述离子溶液对某一波长光吸收的强弱、与吸光物质的浓度及其液层厚度间的关系:
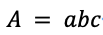
其中“ A ”是物质的吸光度(absorbance),“ a ”是吸光系数,使用仪器前需要校准(calibrate),一般选择能测到A值最大的光波波长(wavelength)去检测,从而把a值也由此确定,如果设定好后再改变波长,A会变得更小。
“ b ”代表吸收层的厚度,取光穿过溶液的长度,一般我们盛放溶液使用的比色皿(cuvette)都是小细管,即使溶液溅撒出去一些,都不会改变吸收的层厚度,但如果直接用手指触碰比色皿,残留在比色皿上的皮肤油脂会折射光,使b增大,所以要用镊子(tweezers)夹取移动比色皿。
“ c ”是吸光物质的浓度(concentration)。仪器校准(calibrate)后,a和b固定不变时,A于c往往呈斜率为固定正数的直线型关系。
54. 色谱法(chromatography)适用于分离溶解度(solubility)不同的物质,依赖于相似相溶原则,Rf=溶质移动距离 / 溶剂前沿移动的距离,Rf越大代表溶质与溶剂相溶程度越高(high solubility), Rf一定是在1到0之间的一个数字。
要特别注意题目可能直接告诉我们溶剂(solvent)的成份或分子极性,这时默认色谱纸本身的极性是没影响的;但也有题目不用溶剂,这时就要关注色谱纸本身的极性(polarity)了。
55. Last but not least,化学经常是很多同学参加的第一门AP考试,同学们考前务必提前打印好准考证,检查好报名时的身份证件是否在有效期内,尽早在考前调整好作息节奏,不要熬夜突击。
相信同学们扎实充分的准备,一定会为这次的AP考试周期开个好头。建议同学们考完后,不要与同学交流考试内容,避免影响后续考试心态,不骄不躁,才能沉着应对更多挑战。
祝福每一位努力的同学,都能收获理想的成绩,把考试当作一次展示学习成果的好机会,加油!May 5 with U~