IGCSE的化学课程涵盖了四大基础化学的内容,涉及范围广,内容量庞大,知识点琐碎繁杂,许多同学在复习时不知从何着手。
今天机构要和大家讲解的就是其中的:
离子键(Ionic bonding)
化学键这部分会涉及到的关键词如下:
化学键的种类分为三种,ionic bonding(离子键),covalent bond(共价键),metallic bond(金属键)。
知识点总结:
ionic bonding(离子键)的构成:metal+non-metal
形成过程:electron transfer (电子的转移)
(金属失去电子,非金属得到电子)
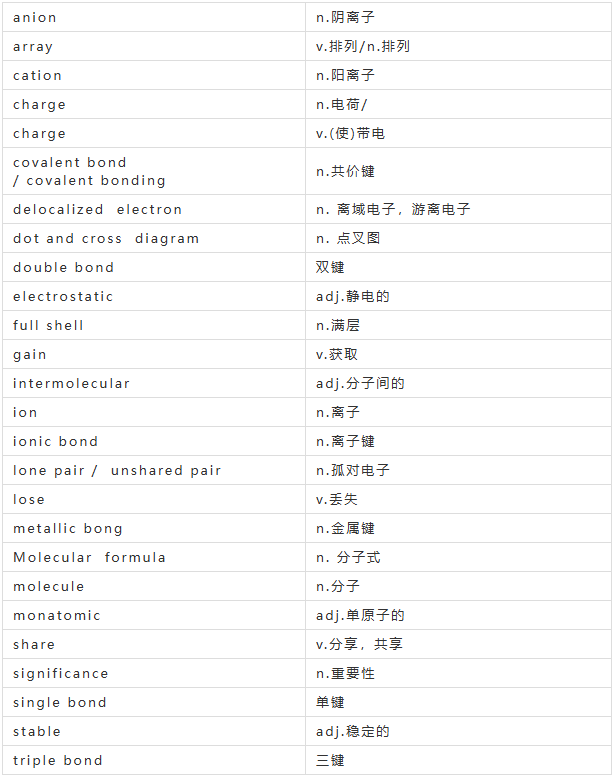
Na原子核外电子排布2,8,1
Cl原子核外电子排布2,8,7
每个原子都非常希望达到最外层为2电子(第一层为最外层时)或者8电子的稳定结构。
👉对Na原子而言,失去一个电子更容易达到稳定结构
👉对Cl原子而言,得到一个电子更容易达到稳定结构
所以:Na原子将最外层的一个电子转移给了Cl原子。
电子转移之后
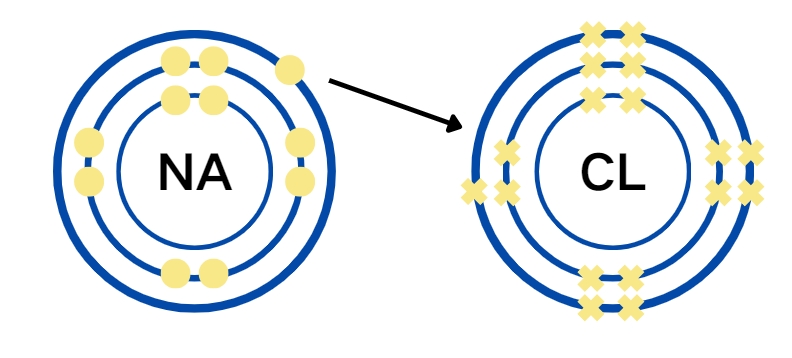
Na原子失去一个电子变成了Na+(sodium cation)
Cl 原子得到一个电子变成了Cl-(chlorideanion)
二者之间的electrostatic attraction force(静电吸引力)就被称为ionic bond(离子键)。
一个cation吸引一个anion,然后正负电荷相抵消,就形成了NaCl这个ionic compound。
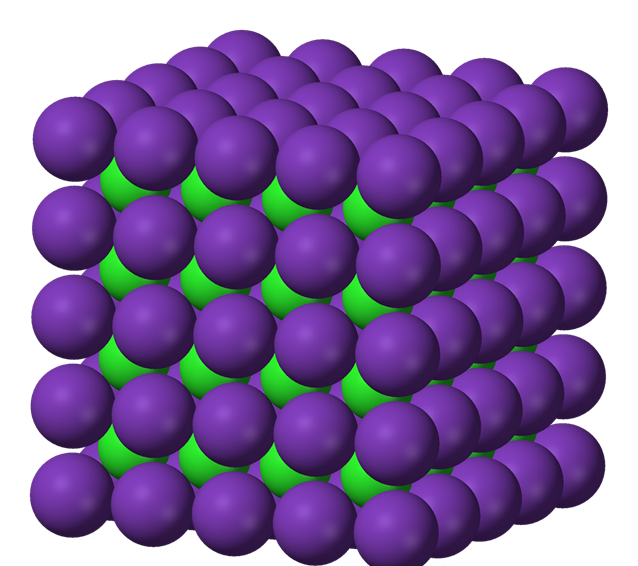
ionic bonding(离子键)对应的化合物ionic compound(离子化合物)的结构:
这里面紫色的微粒代表cation,绿色的微粒代表anion,正负电荷相互吸引,而且引力非常强,一般情况下不容易被破坏。
这种结构有一个专属名词:lattice(晶格)。
你会发现这里面的cation和anion很多,而且排列还挺有规则的,但这也只是这个ionic compound的结构的冰山一角,这个ionic compound的结构是按这个结构的排列方法一直往外延伸的,所以这个ionic compound的结构非常大,所以有时我们也说它的结构是giant ionic structure(大离子键结构)。
ionic compound(离子化合物)的性质:
结构决定性质。就是因为ionic compound具有上述结构,所以才会显现出以下性质:
property 1:high melting point
原因:strong bonds between cations and anions
由于正负电荷之间的静电引力比较强,所以想要破坏就比较难,对应化合物熔沸点一般就比较高
property 2:do not conduct electricity when solid
原因:have no mobile ions
由于正负电荷之间的静电引力将cation和anion紧紧吸引在一起,都不能自由移动,而导电需要有自由移动的电子或离子的存在
property 3:conduct electricity when molten/aqueous
原因:have mobile ions
molten就是加高温去破坏阴阳离子之间的静电引力,被破坏之后cation和anion就都恢复自由身了,就满足导电的条件了;而aqueous就是将离子化合物放入水中,形成溶液,水分子作为外来分子,会用自身的力量去把cation和anion拉开。
相关历史:
1913年,威廉·亨利·布拉格和威廉·劳伦斯·布拉格确定了氯化钠的晶体结构。
他们发现每个原子都有六个等距的相邻原子,表明了这些成分不是排列成分子或有限的聚集体,而是一个长距离的网络晶体排列。许多其它的无机化合物也被发现具有类似的结构特征。
这些化合物很快被假设是由离子而不是电中性的原子构成,但直到1920年代中期进行X射线反射实验(检测电子密度)时,才发现了这一假设的证据。