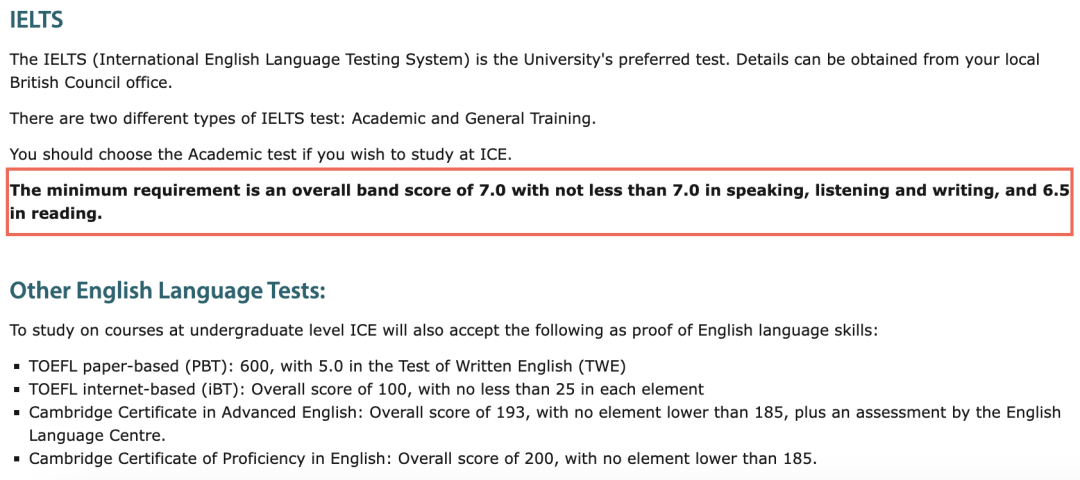
不论是ALevel还是IGCSE/GCSE化学,Bonding(键)都是一个不太好理解的知识点,尤其是初学接触。今天重点讲解离子键(Ionic bonding
物质是由atoms组成的,而atoms由chemical bonding结合在一起。
到底什么是bonding?
简单来说,bonding就是一种attraction,也就是吸引力,通过吸引力将atoms结合在一起。关于chemical bonding我们学过三种,Ionic bonding,covalent bonding以及metallic bonding。而这三种bonding中的是谁和谁之间的吸引力略有差别而已。
今天我们重点讲解第一种Ionic bonding。
关键词
化学键这部分会涉及到的关键词如下:
| anion | n.阴离子 |
| array | v.排列/n.排列 |
| cation | n.阳离子 |
| charge | n.电荷/ |
| charge | v.(使)带电 |
| covalent bond
/ covalent bonding |
n.共价键 |
| delocalized electron | n. 离域电子,游离电子 |
| dot and cross diagram | n. 点叉图 |
| double bond | 双键 |
| electrostatic | adj.静电的 |
| full shell | n.满层 |
| gain | v.获取 |
| intermolecular | adj.分子间的 |
| ion | n.离子 |
| ionic bond | n.离子键 |
| lone pair / unshared pair | n.孤对电子 |
| lose | v.丢失 |
| metallic bong | n.金属键 |
| Molecular formula | n. 分子式 |
| molecule | n.分子 |
| monatomic | adj.单原子的 |
| share | v.分享,共享 |
| significance | n.重要性 |
| single bond | 单键 |
| stable | adj.稳定的 |
| triple bond | 三键 |
Electronic configuration
电子排布
原子核外的电子遵循一定的规律排布在原子核的周围,而我们一般只关注最外层电子,而最外层电子也决定了某些化学反应。
而从元素周期表Periodic table中也可以发现电子排布的一些规律,Group告诉我们最外层电子数,Period告诉我们电子层数。
举一组metals和non-metals的例子,
Metals 金属
Na 2,8,1
K 2,8,8,1
Mg 2,8,2
Ca 2,8,8,2
Non-metals 非金属
O 2,6
F 2,7
Cl 2,8,7
离子
原子在参与化学反应的过程中都希望最外层达到满电子(full outer shell)的状态,这样会变得更稳定。因此金属原子会失去最外层电子,非金属原子会额外得到电子而达到满电子层。
金属原子如果失去(lose)最外层电子,就会形成positive ion。
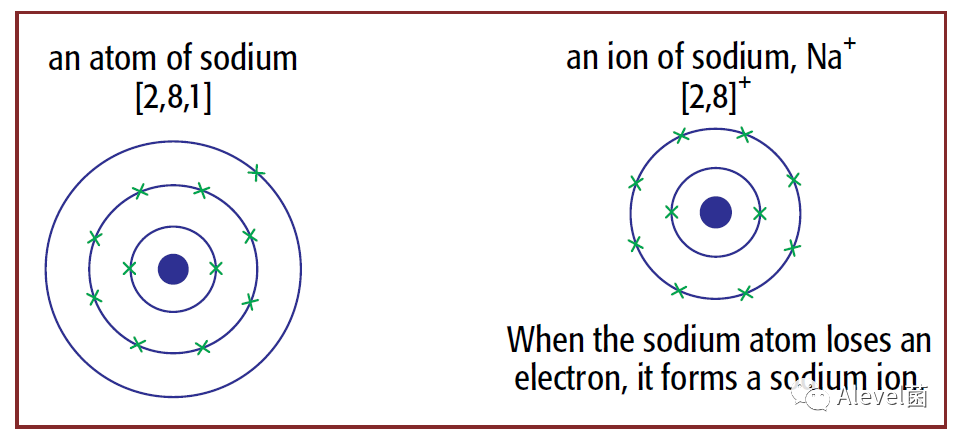
非金属原子如果得到(gain)额外的电子,就会形成negative ion。
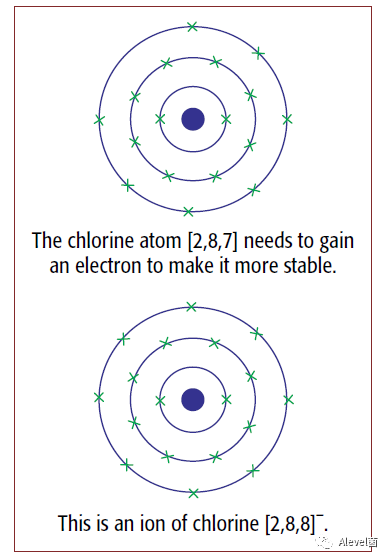
Ionic compound
离子化合物
就拿上图中的Sodium ion 和ion of chlorine来说,Sodium失去的电子被chlorine得到,分别形成一个正离子,一个负离子,正负之间就会出现静电吸引力,而这个吸引力就是ionic bonding。而形成的这类化合物叫Ionic compound。
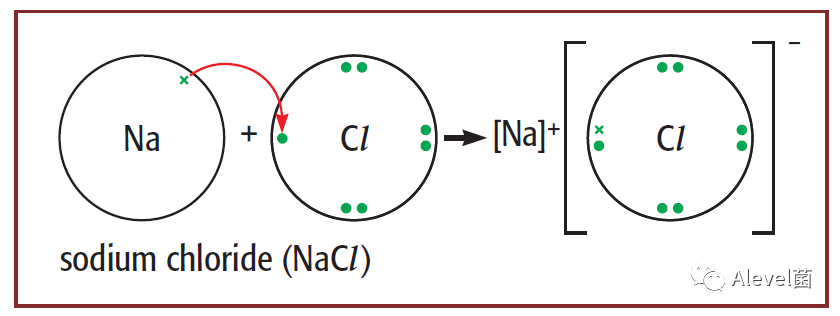
下图是sodium chloride形成过程,
我们再举一个例子,magnesium oxide,