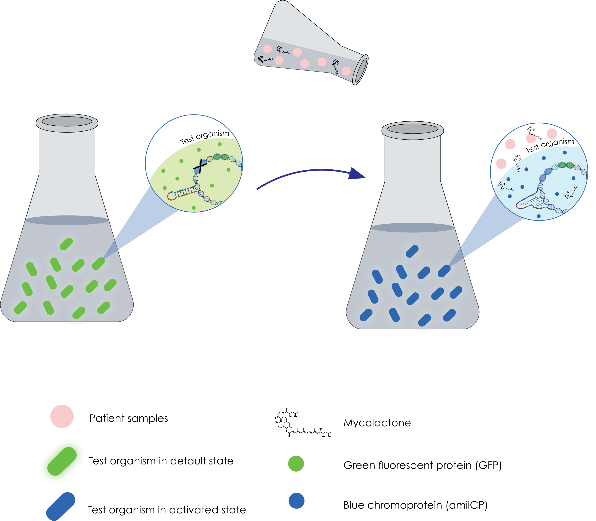
2022年3月22日晚8:00,我们对Y老师、L老师展开了线上采访。
Y老师现任厦门大学妇儿医院临床检验科副主任、检验医学副教授,主要研究方向为临床免疫学和临床分子诊断学。L老师现任妇女儿童医院临床检验科的实验室研究员,主要研究方向是生物传感器和临床分子诊断学。此次采访中,我们与两位老师就利用等温扩增技术 (Catalyzed Hairpin Assembly,英文缩写即CHA)进行核酸检测进行了讨论。
在简要介绍完我们的设计思路后,我们向两位老师询问了课题设计方向上较为关心的几个问题。
首先是关于CHA特异性的问题。老师告诉我们,CHA特异性的关键在检测序列的选择。检测序列不仅应具有保守度,还需要有成茎环的特异性,而茎环在不同环境中,可以生成的最稳定二级结构也是不同的。如果非目标结构较多,则会产生假阳性。因此检测序列设计最重要的是使其形成二级结构的茎环尽可能少,这一目的除了可以通过软件评估来实现,还可利用更方便的电泳方法看结构。L老师用自己的研究实例向我们展示了电泳方法,如果同一样品可以得到多个条带,则说明有多个二级结构,表明该序列特异性不太好。
此外,灵敏度和特异性是相互矛盾的。CHA灵敏度很高,检测限度可达到10 -15mol /L,我们检测的物质浓度远比该检测限度高,此时重点考虑的问题不是灵敏度,而是特异性。同时要注意,在我们使用的范围内检测物浓度和信号表征是否仍旧呈线性相关。
随后,我们询问了关于CHA成本的问题。老师告诉我们,CHA每检测一次就加一次探针,只需要合成核酸序列,成本特别低。同时由于我们的检测样本浓度远高于CHA的检测限度,所以不需要进行信号放大,成本会更低。然而,由于我们检测的是单链,而靶标DNA是双链,所以需要一个将双链转换成单链的过程。
此外,老师还提到,由于利用发卡结构检测实际样品时容易受到干扰,因此他们实验时会去检测哪些因素会对靶标检测性有干扰 ,其先后顺序为:触发序列长度、温度、反应时间、茎环浓度和比例。同时,CHA在细菌检测上用的比较少,在老师看来,我们的设计是一个创新点。
最后,两位老师一致认为我们设计的这种体系是能满足实用性需求的。同时,他们也认可了我们的课题,并表示他们的实验室也有这方面的项目正在进行,很乐意向我们提供帮助。