文献标题:Native CRISPR-Cas-Mediated Genome Editing Enables Dissecting and Sensitizing Clinical Multidrug-Resistant P. aeruginosa
DOI号:10.1016/j.celrep.2019.10.006
关键词:铜绿假单胞菌;耐药性;CRISPR-Cas
摘要:
利用铜绿假单胞菌的内源I-F型CRISPR-Cas系统,建立的一种适用于其临床/环境分离的耐药性菌株的高效且原位的基因编辑技术
1.背景
AMR:Antimicrobial resistance,耐药性
MDR:multidrug-resistant,多重耐药性
铜绿假单胞菌是一种分布范围广的典型的多重耐药性病原菌,它本身就能抵抗很多种药物,并且它从外界获得耐药性的能力也很强。铜绿假单胞菌的基因组很大(6.4 Mbp)并且多变,因此,用在典型铜绿假单胞菌上的基因编辑系统对临床/环境分离出的具有多重耐药性的铜绿假单胞菌不太适用。并且,常常有成簇的抗药性标志性序列(marker)出现在临床的MDR菌株的基因组和可移动元件上,这些marker被发现对细菌的抗药性水平具有重要的影响,于是,靶向这些maeker是很有效且必要的。
研究表明,在AMR 铜绿假单胞菌中,有70%具有I-F型CRISPR系统。之前也有用细菌的内源性CRISPR系统来原位编辑致病菌的成功案例,于是作者也尝试用这个办法来对MDR铜绿假单胞菌编辑。
研究对象:
一种MDR铜绿假单胞菌,PA154197
PA154197性质特点:
i.与另一种高危细菌ST175有类似的抗性
ii.有native I-F CRISPR-Cas Locus
以下展示研究结果。
2. 对PA154197内源性CRISPR系统进行功能性分析
PA154197具有典型的I-F完整系统:完整的Cas蛋白和array(P.S.它的不同的repeat之间只有一个碱基的差异;spacer几乎都是32bp,并且很多是噬菌体的同源序列)。
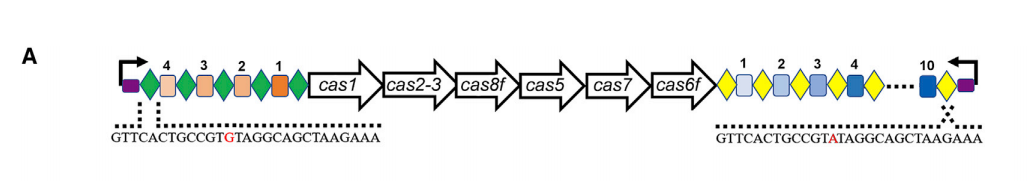
Target gene:mexB基因,编码内膜组分,是一种AMR基因
Spacer的选择:之前的研究认为,按5’-protospacer-GG-3’的相对位置选取protospacer、并且以GG为PAM是比较合理的,但近期有人又建议,以guide-centric(5’-CC-3’)比target-centric(5’-GG-3’)更合理,于是就按5’-CC-protospacer-3’的相对位置来设计spacer。
3.验证mexB的敲除水平
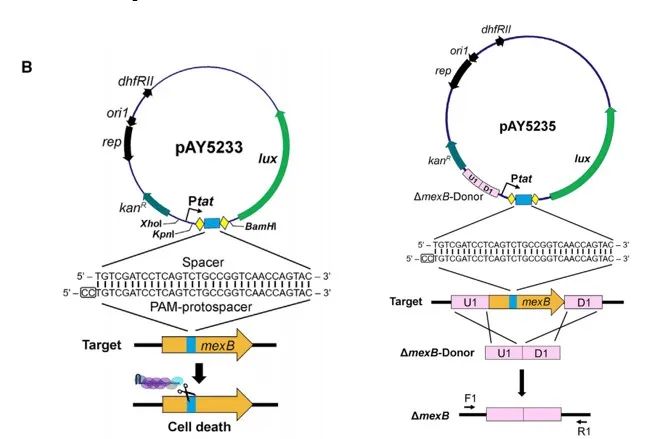
(1)为了验证mexB敲除能力和修复能力,所使用/构建的质粒:
质粒pAY5211:空载质粒,具有卡那霉素抗性基因和Ptat启动的lux(luminescence,荧光素)基因,作为对照组。
构建质粒pAY5233:在有卡那霉素抗性的pMS402骨架的lux基因上游用强启动子Ptat表达靶向mexB的array序列,执行敲除mexB任务的质粒,称为targeting plasmid。当mexB被剪切后,细菌genome常常会紊乱,导致自身的死亡;
构建质粒pAY5235:将一个1kb的donor序列插入到pAY5233上,该序列由mexB的上游和下游的500bp的同源臂组成。质粒pAY5235称为editing plasmid。若mexB被剪切出口子,在一些菌中,mexB的这两段同源臂会和mexB同源重组,同源重组后这个gene就被修复好了,不会阻碍genome的正常工作,使得pAY5235本身可以稳定存在,菌落呈现荧光状态。
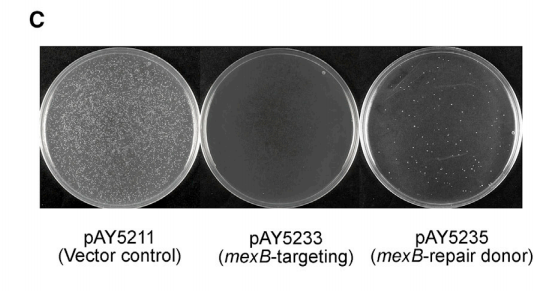
(2)检验基因敲除水平和功能性质粒对已编辑细胞的修复能力
实验步骤:向菌中转pAY5211(对照)、pAY5233(targeting plasmid)和pAY5235(editing plasmid),通过菌落克隆的荧光状态判断质粒转化水平。
实验结果和结论:
i.比较转化pAY5211和pAY5233的两组:pAY5211组中表达有荧光素的阳性克隆多,pAY5233组中几乎不存在表达有荧光素的阳性克隆,因此说明pAY5211的转化成功率比pAY5233高的多,进一步证明pAY5233组中的菌内发生了“detrimental chromosome cleavage”,导致细菌难以存活;这个结果说明,靶向mexB的基因敲除成功并且敲除水平较高。
ii.把转化pAY5235的组和前两组比较:pAY5235组出现了少量具有荧光的阳性克隆,说明部分细菌在mexB被敲除后进一步进行了同源重组、将genome修复,因此细菌可以正常存活,进而正常表达卡那霉素抗性和荧光素——这个实验证明了:由于这个CRISPR系统执行的基因敲除而给基因组带来的破坏是可以被修复的,也就是说,使用可编程质粒对细菌进行多轮编辑是可行的。下面那张在试管培养的图同样是在证明这一点。

(3)此外,本研究还表明,当target gene小于1kb时,敲除的成功率会>90%。如下图所示:
我的理解就是,这个实验是以mexB基因内的不同长度的区域当作不同的target gene,通过判断不同长度区域被完全剪切的效率来判断不同长度的target gene的剪切成功率。下面这个实验就在判断mexB内具体有多长被切掉了。原理是,Cas2/3剪切target gene后会剩下来长短不一的序列,用不同的引物去PCR,看能P下来的片段是完整长度的还是中间一段被剪切掉后两端剩下的长度,P下来完整长度就说明敲除失败,P下来是只有两侧剩余的长度就说明敲除成功。
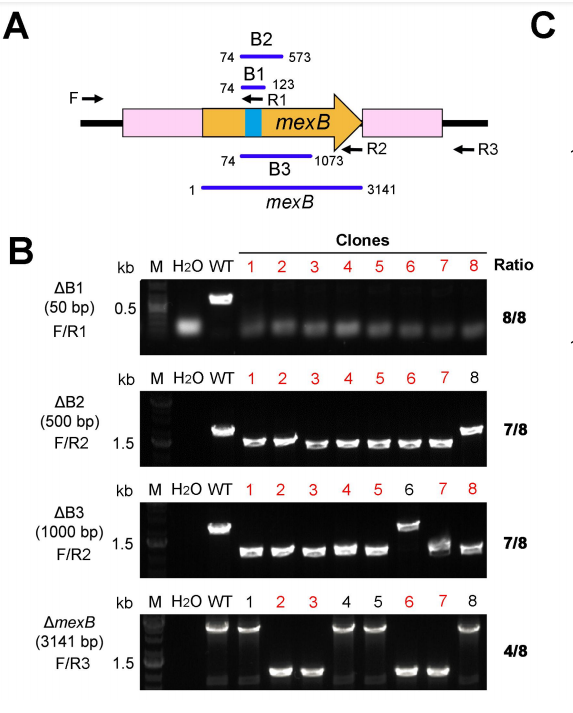
由图可以看出,和array靶向范围(32bp)很近的50bp序列的敲除成功率是100%,比array靶向范围稍远的500bp序列的敲出成功率大约是87.5%,1000bp序列的成功敲除率也大概是87.5%,3000多bp时候(整个mexB基因)敲除率就大概只有62.5%了。
3.利用CRISPR 系统对耐药性机理探究
构建了ΔmexB、ΔmexF和ΔmexH突变体(对应参与编码下面三个外排泵的组分),并检测了三个外排泵MexAB-OprM、MexEF-OprN和MexGHI-OpmD对PA154197耐药性的贡献——转录组分析表明这些基因过表达。
ΔmexB和ΔmexF都引起了一些种类的抗生素的MIC(最小抑菌浓度)下移,ΔmexH没有明显带来的MIC改变。作者进一步对ΔmexB和ΔmexF进行了组合敲除,比较其敲除单基因的MIC上的变化,最后得出结论:MexAB-OprM和MexEF-OprN同时过表达构成PA154197的主要耐药决定因素。
(本文剩下的内容对耐药性机制进行进一步的详细研究,主要研究方法和“3”类似,就是用CRISPR机制敲除某一些基因,然后研究单基因对耐药性的影响或多基因之间的关系,这里不再赘述)