文献分享
Designing Biological Circuits: Synthetic Biology Within the Operon Model and Beyond(1)
本文回顾了Jacob和Monod所构想的电路蓝图如何为第一代合成基因电路的构建奠定了基础。这一蓝图的核心思想是,通过组合简单的功能单元,按照编码的分子机制运作,可以编程复杂的行为。文中举例说明了微生物合成生物学中最常见的合成基因调控策略与Jacob和Monod早期预测之间的惊人相似之处。第一代合成基因电路对我们理解基因调控网络的结构和功能以及噪声在基因表达调控中的作用都有重要贡献。
文章的后半部分重点介绍了生物化学和分子生物学在发现和开发可定制和可编程激活内源性行为的新分子工具方面的作用。探讨了基因调控的根本性进展如何在超越操纵子模型的工程策略方面发展,以及合成基因线路如何帮助完善当代生物学模型。这些例子突出了基础生物学和合成生物学之间持续而有建设性的相互影响。
PartⅠ.Synthetic biology within the operon model
本节主要讨论了操纵子模型及其理论框架对早期合成生物学工作的深远影响。文章首先对操纵子模型理论的结论和猜想做出总结,以便读者更好地理解操纵子模型理论。随后便开始阐述Jacob和Monod所提出的操纵子模型的蓝图,以及与早期合成基因电路之间的惊人相似之处,讨论了转录调控策略的扩展。
Ⅰ.双稳态开关和振荡器
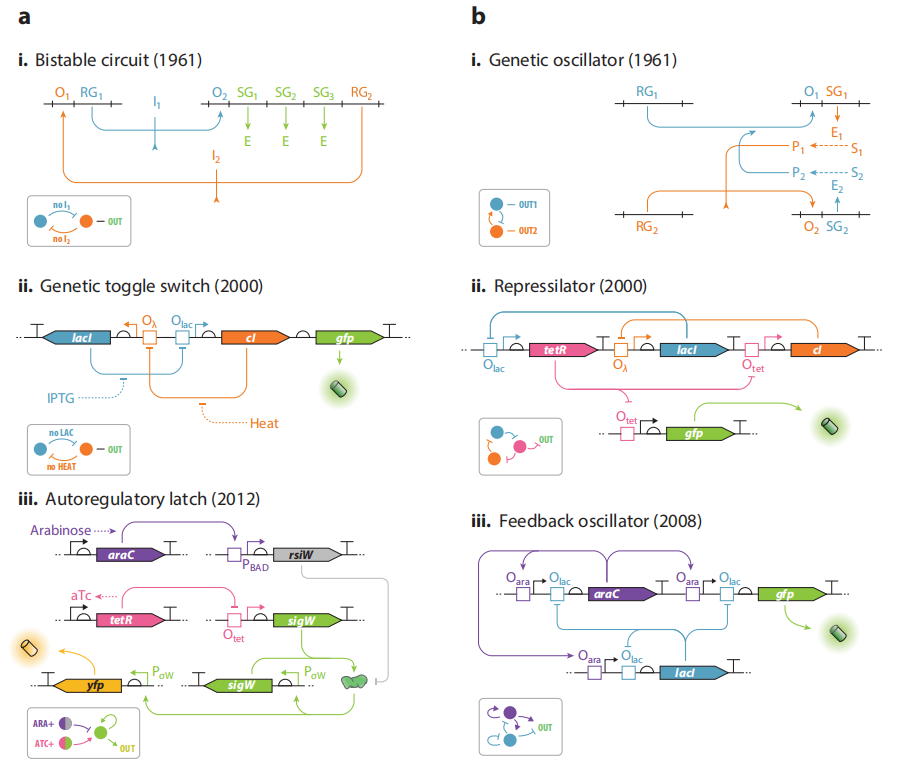
图1.操纵子模型与初代合成生物学基因线路。
a. 双稳态开关和振荡器
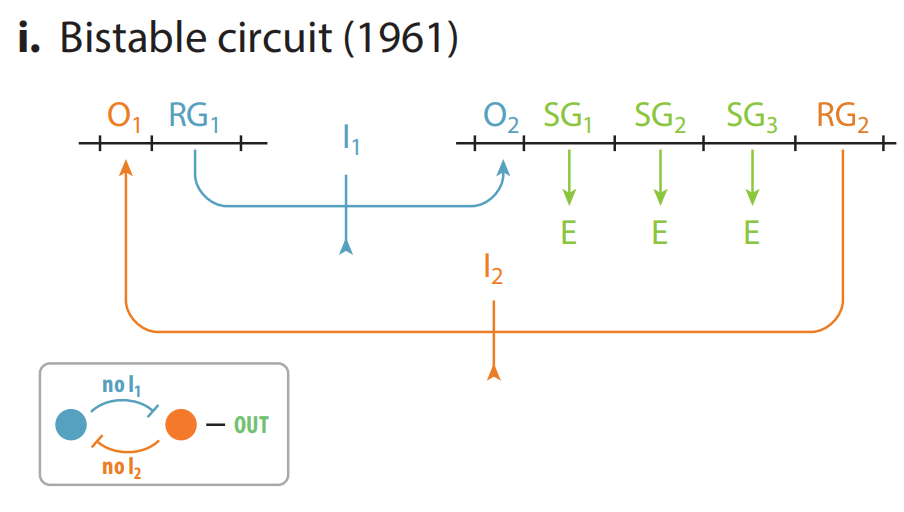
(i) Jacob和Monod提出的双稳态调控系统蓝图。这种结构能使带有相同基因的细胞表现出两种不同的表型。由两个假设的操纵子编码两种抑制子,分别由相应的操纵基因控制。这种结构能够建立起两种不同的、相互排斥的细胞状态,取决于两种抑制因子中的哪一个占主导地位,结构基因只有在与主要调控因子处于同一个操纵子时才能被表达。此外,他们还预测阻遏物能够与各自的配体变构结合从而被抑制,这样系统就可以在两种稳定的状态之间转换。
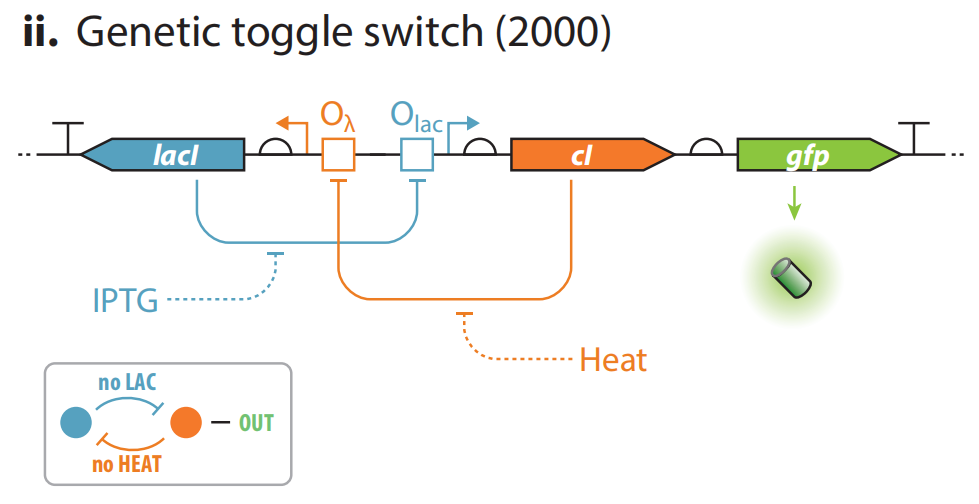
(ii) 双稳态开关,初代合成基因线路之一,是上述模型的一个实例。由两个相互抑制的操纵子组装而成,分别编码细菌阻遏物LacI和噬菌体阻遏物cI(或TetR)。与上述的蓝图几乎一样,能让细胞在两种状态之间切换。
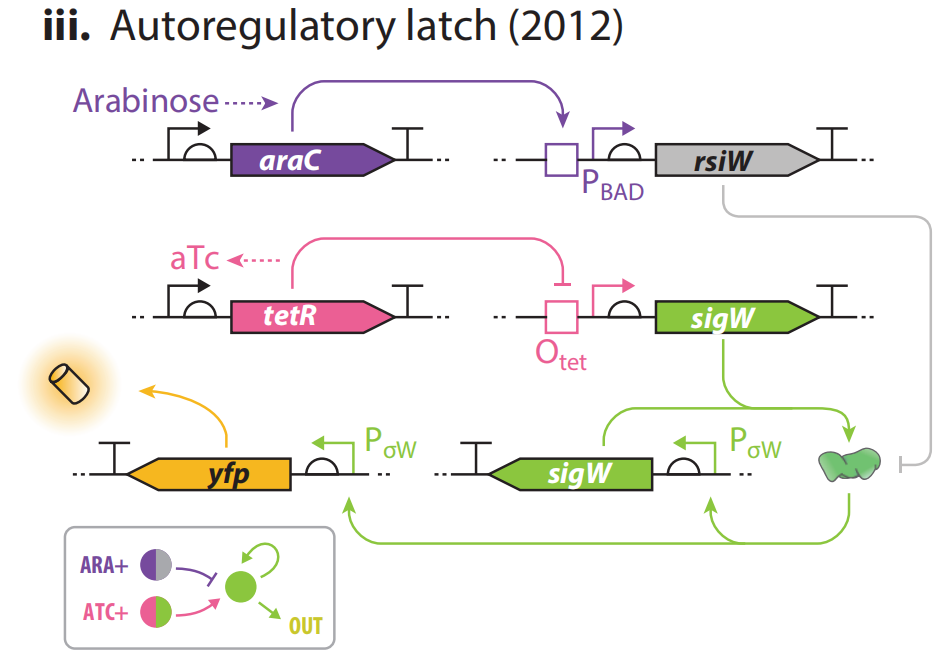
(iii) 另一种双稳态开关。用一个单独的自动激活因子取代了两个相互对立的转录抑制因子,证实了正向调控可以支持双稳态表达系统。σ因子sigW 处于正向自动调节状态。上游可以设计两种调控方式。
①aTc与tetR结合,开启sigW的表达,下游的启动子PσW开启,起到一个正反馈的效果,又有sigW的表达,同时开启下游yfp的表达;无aTc,sigW的表达被抑制,两个PσW都不开启,无yfp的表达。
②有阿拉伯糖,反σ因子rsiW表达,阻隔sigW。
b. 依赖于反馈调节的基因振荡器。
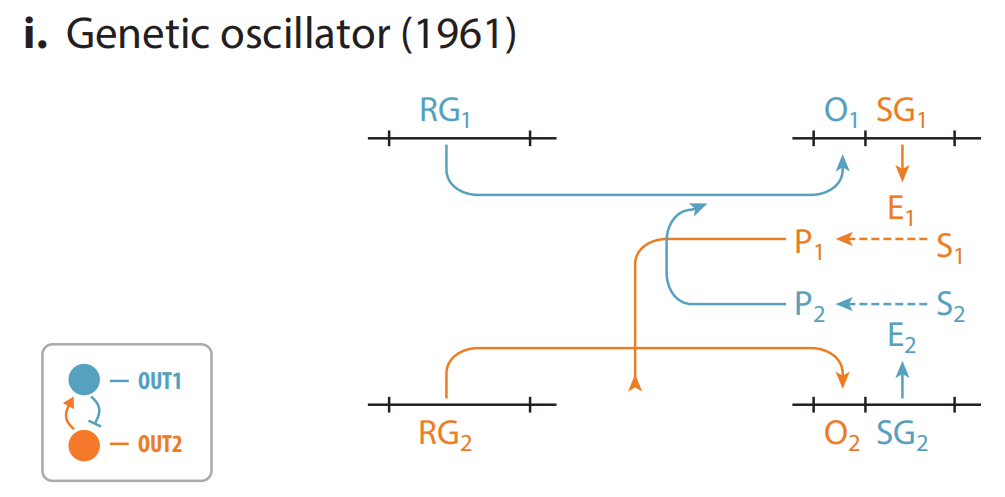
(i)Jacob和Monod设计的基因振荡器蓝图,可以让基因表达产生循环模式,同样也是围绕两个不同的操纵子之间的相互调节来构建的。每一个操纵子被另一个调控因子抑制,同时编码一种酶,催化小分子的生成。这些小分子可以反过来变构调节相反的调控因子。比如,操纵子1的代谢产物可以解除操纵子2的抑制作用,而操纵子2的产物可以促进操纵子1的抑制作用。据他们预测,在适当的生化参数条件下,两个操纵子的活性会随时间产生振荡。
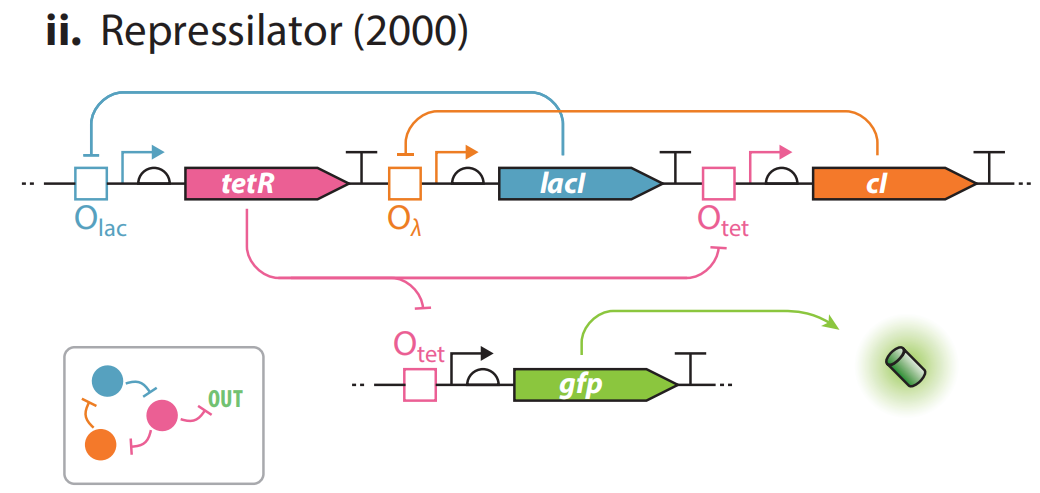
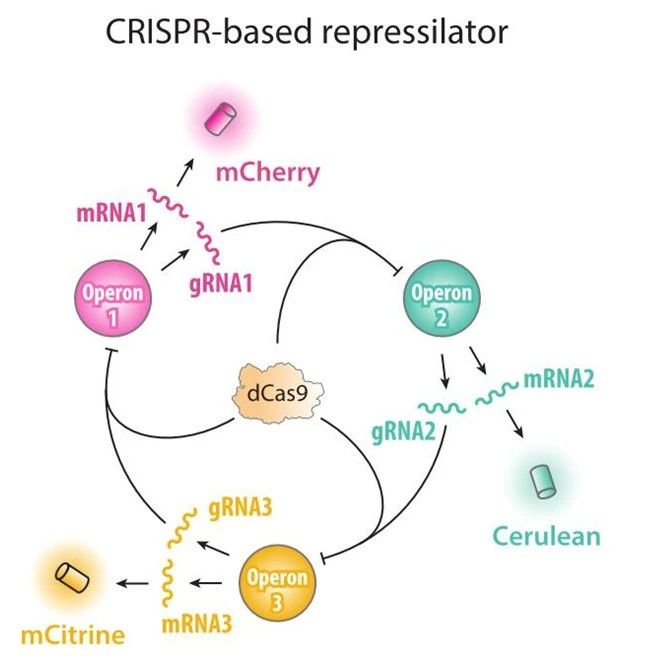
(ii)抑制振荡子。不依赖于混合调控和酶转化,而是完全建立在转录抑制的基础上,使用双重抑制调控来替代蓝图中的正向调控。在该电路中,编码三种抑制因子lacI,cI,TetR的基因以“菊花链”式连接,由tetR调控绿色荧光蛋白的产生。有tetR产生时,抑制cI和gfp的转录,cI的抑制作用解除,lacI能够转录,反过来抑制tetR,一段时间后,tetR对cI和gfp的抑制作用被解除,产生绿色荧光。而cI的表达又会反过来抑制lacI,又逐渐解除lacI对tetR的抑制作用,一段时间后tetR又能够表达,以此循环。细胞则表现出绿色荧光随时间振荡。
该线路的实现证实了自主的动态行为能够通过基因编辑来实现,为节律理论创建了最小模型。以上这些线路的实现证实了调控基因和操纵基因的不同组合可以产生复杂的行为。
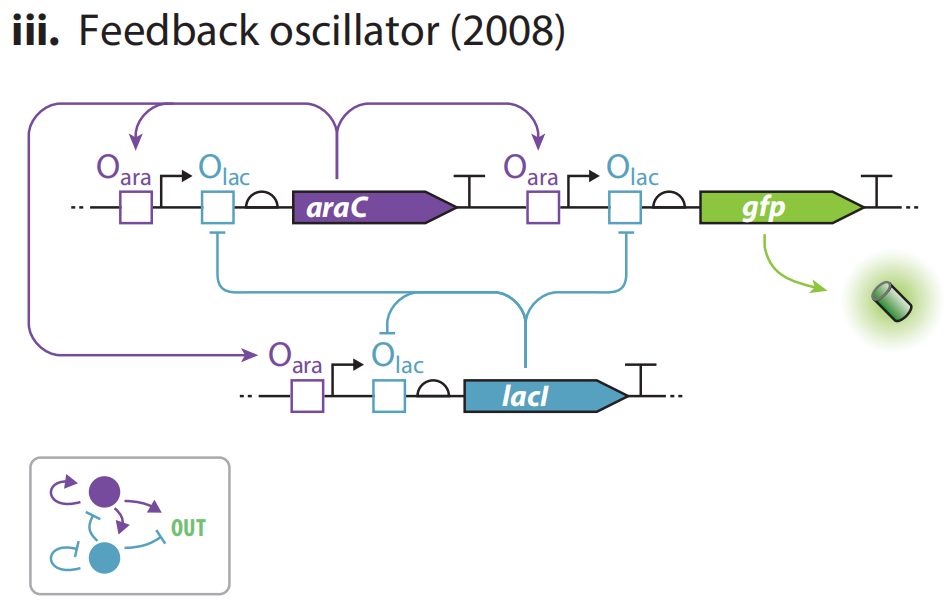
(iii)2008年,Stricker等人构建了一个可调基因振荡器,周期更短,振幅更大。使用双输入的混合启动子,能够同时响应激活子AraC和抑制子LacI,在基因网络的每个分支上同时实现正和负的自动调节。利用这两个正交传感器,他们可以对震荡周期进行微调,使用阿拉伯糖和IPTG来进行参数调整。结果显示,该线路可以在噪声条件下稳定表达。
他们进一步探索该模型,揭示了一个简单的由自抑制LacI元件组成的负自调节电路足以产生振荡,被称为Goodwin振荡器的结构,实验验证后,作者将其归因于lacI基因表达与活性lacI TF复合物形成之间的固有延迟。
Ⅱ.正反馈和负反馈
他们将反馈调控的概念延申到基因调控网络。反馈可以来自调控因子直接对自身的调控(自动调控),或间接通过其目标操纵子的下游产物来调控。研究表明,负反馈自动调节可以提高遗传线路的稳定性。
Becskei和Serrano开发了一种最小的合成基因线路,使用荧光标记的TetR阻遏物,在两种情况下测量了蛋白质水平在种群范围内的分布:a.将tet操纵基因置于tetR-gfp融合基因上游的自动调节系统。b.tetR-gfp的表达不受调控。结论显示,在噪声存在的情况下,自动调节提高了表达的稳定性,减少了大肠杆菌种群中的基因表达异质性。
由此提出一个猜想,即操纵子产生自身诱导物,会表现出全有或全无的转录行为。而事实上,早期酵母自我激活的TetR转录因子的研究表明,在双稳态开关转换中存在正向自动调节。随后便有研究者在大肠杆菌中开发了类似的正反馈调节系统模型。
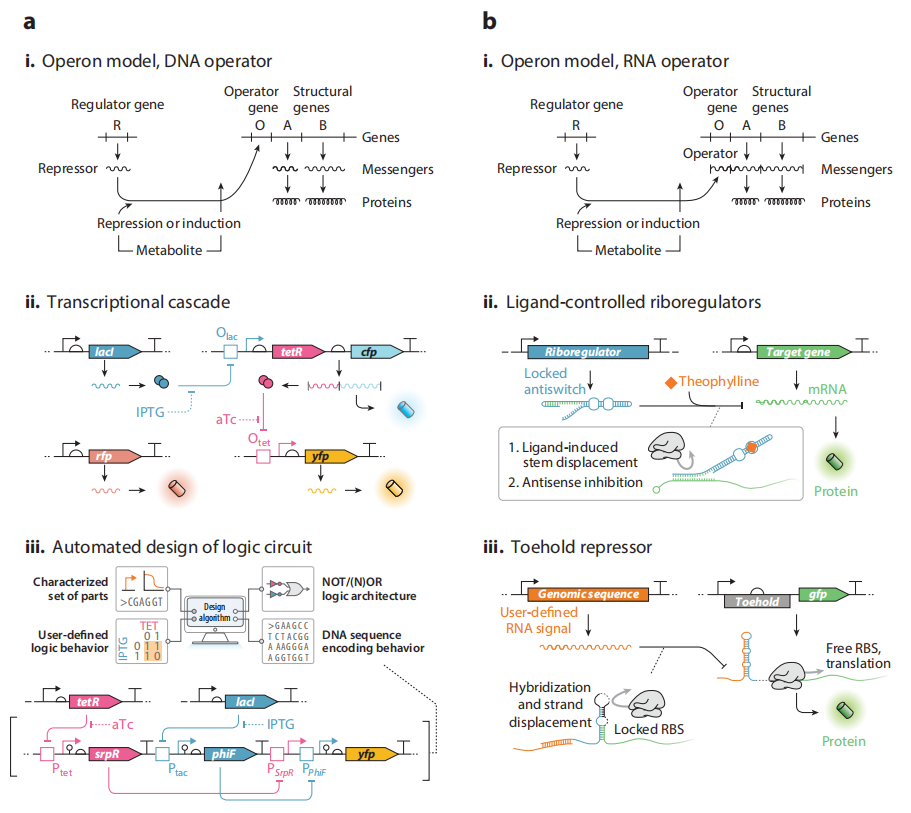
图2.操纵器模型的蓝图及其构建,包括DNA水平和RNA水平两方面
a.DNA水平操纵器
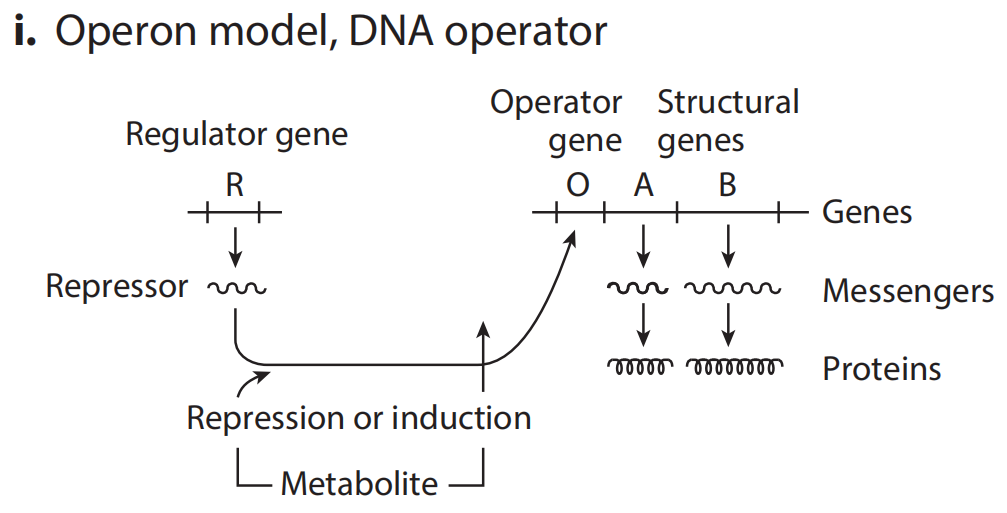
(i)DNA水平操纵器的操纵子模型。调控基因的表达产物作用于下游的操纵基因,抑制转录的发生。
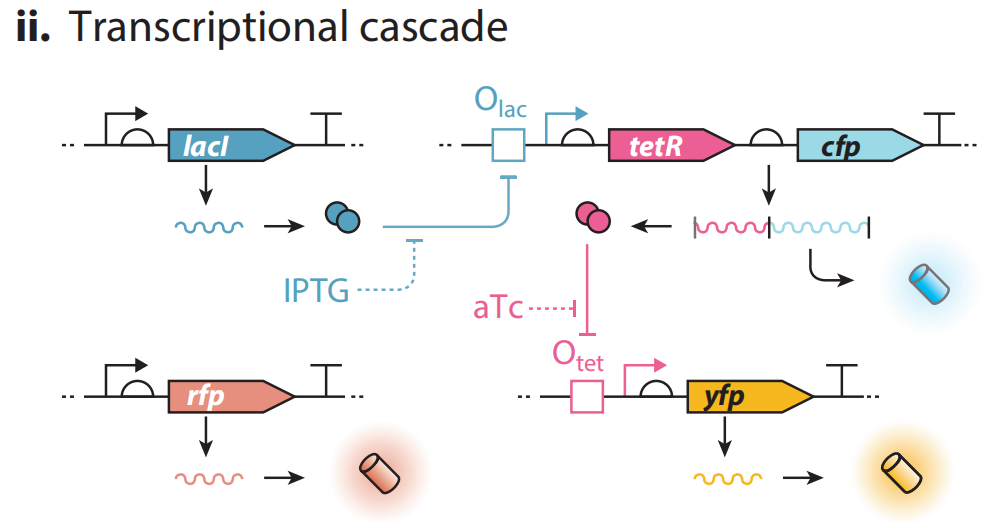
(ii)级联系统。由两层级联系统,分别由两种荧光蛋白表征,和一个单独的报告基因rfp组成。单独的报告基因有利于衡量噪声的影响。lacI正常转录时,抑制Olac,使tetR和cfp不能转录,无青色荧光,tetR不能转录的情况下,yfp能表达,产生黄色荧光。如果存在IPTG,lacI对Olac的抑制作用解除,tetR和cfp开启转录,产生青色荧光,tetR转录抑制Otet,yfp不能转录,无黄色荧光。如果IPTG和aTc同时存在,aTc结合TetR,解除其抑制作用,则青色荧光和黄色荧光同时表达。
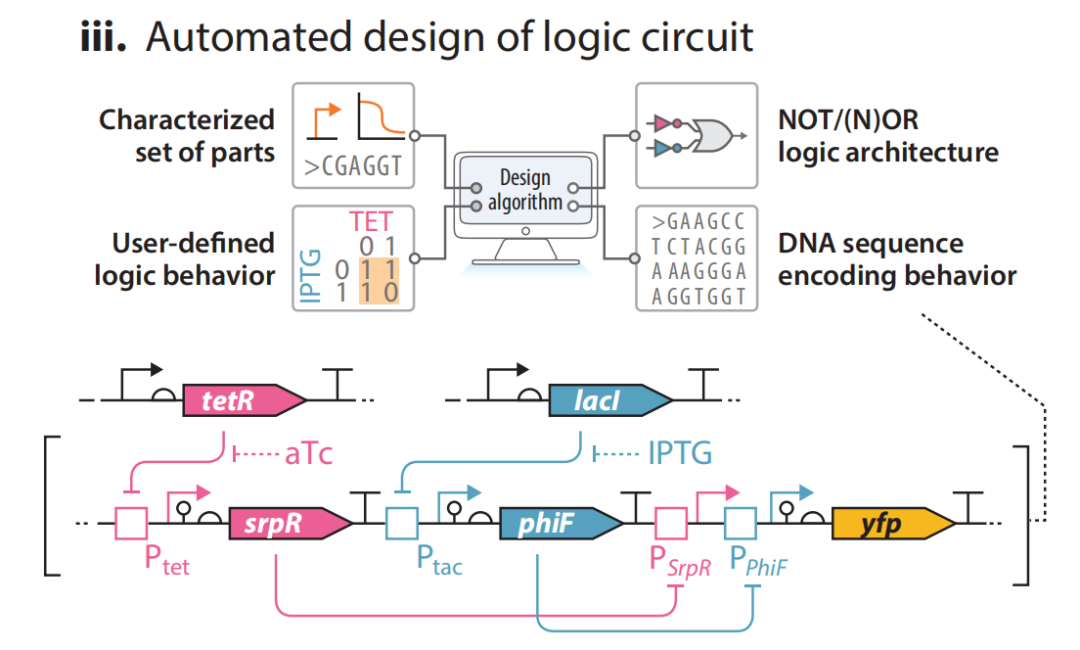
(iii)自动设计逻辑线路。使用基于NOT/NOR的结构,将用户定制的二进制逻辑行为作为输入,设计复杂的转录级联以在大肠杆菌中实现该逻辑。以小分子诱导剂,如IPTG和aTc等作为输入,让用户编辑特定行为。该图展示的是一个NAND逻辑门(与非门)结构。当aTc单独存在时,Ptet被解抑制,srpR表达,激活PSrpR,使yfp表达;同理,IPTG单独存在时yfp表达;aTc和IPTG都不存在时,PSrpR和PPhlF都被激活,yfp表达;aTc和IPTG都存在时,PSrpR和PPhlF都不能被激活,yfp不表达。
b. RNA水平的操纵器
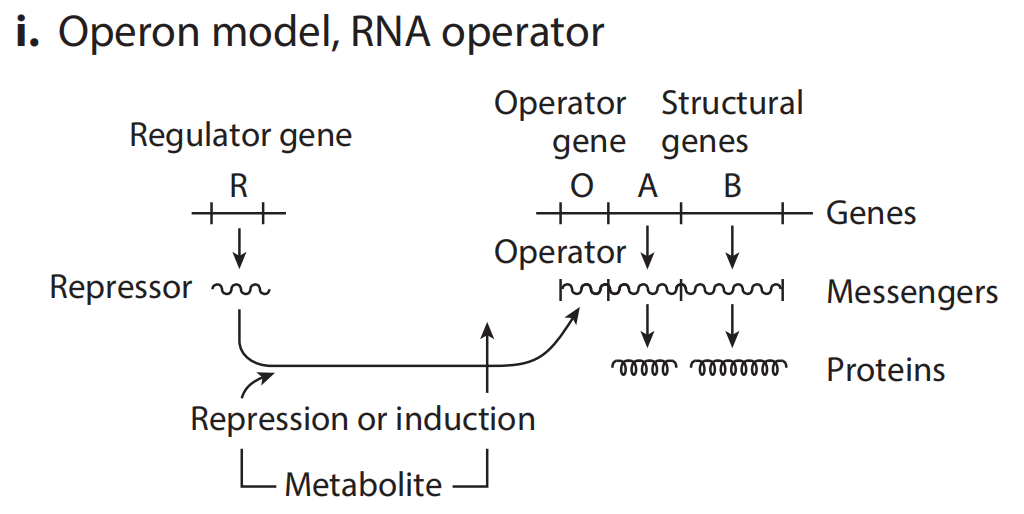
(i)Jacob和Monod在模型中假设调控因子(反义RNA或TF蛋白质)可以靶向mRNA上的特定控制位点,阻碍翻译过程,由此建立了这个操纵器模型。
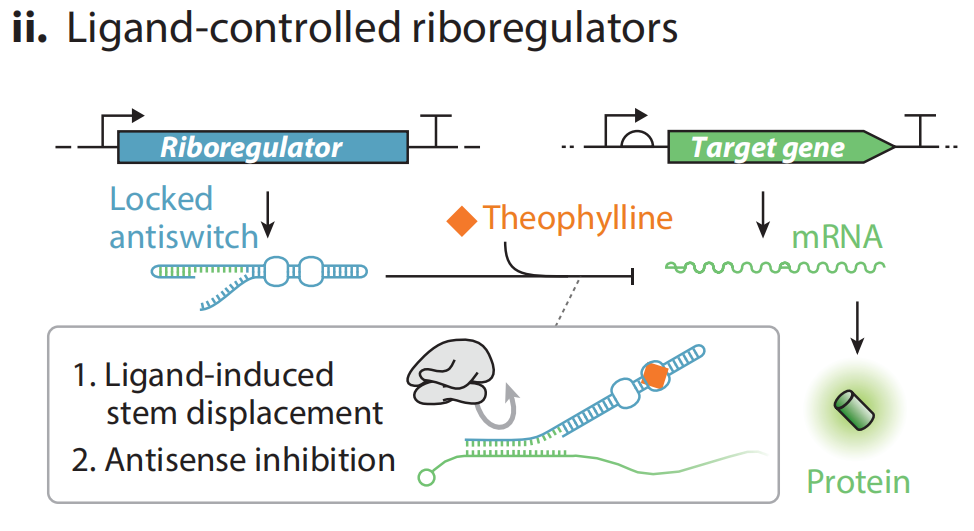
(ii)转录后调控策略。设计非编码RNA特异性阻碍mRNA的翻译,利用反义RNA的茎环结构阻碍核糖体与RBS的结合,从而阻止翻译过程。基于该平台开发了一种配体响应式翻译RNA开关系统,通过特定小分子(如茶碱)与反义RNA特定位点的结合改变反义RNA的构象从而使反义结合结构域隔离或暴露。
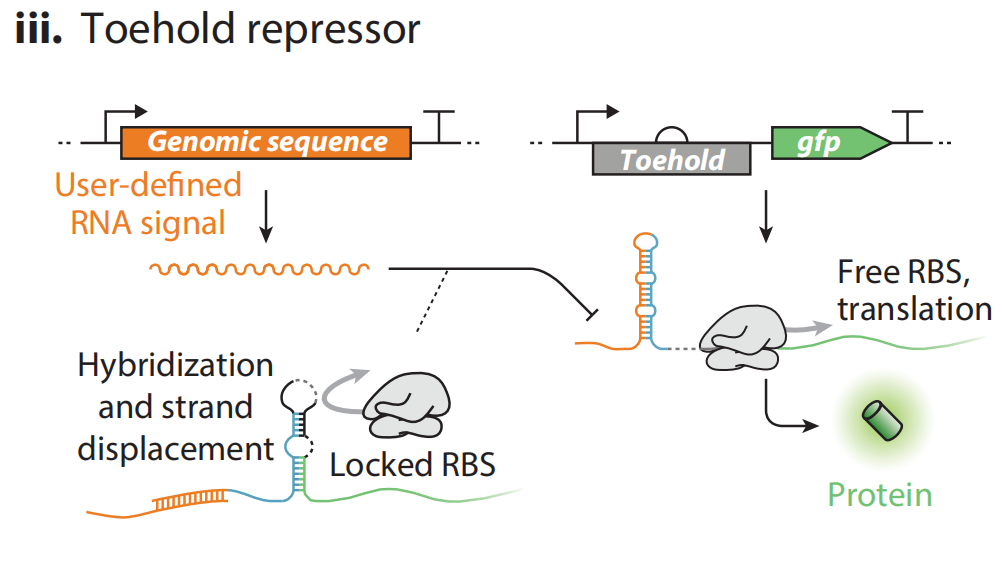
(iii)Toehold switch是一种人为设计的转录后调控因子,可编辑的RNA分子与mRNA结合并将RBS隔开在茎环区域,使核糖体无法结合。经过改造,RBS的隔离与暴露可以被特定的RNA小分子诱导调控。