文献标题:
Constructing E.coli Co-Cultures for De Novo Biosynthesis of Natural Product Acacetin
DOI号:
https://doi.org/10.1002/biot.202000131
关键词:
微生物共培养;异源生物合成;从头合成
内容摘要:
模块化共培养工程是复杂天然产物生物合成的新兴方法。在这项研究中,构建了分别由两种和三种大肠杆菌菌株组成的微生物共培养物,用于从简单的碳底物葡萄糖中从头生物合成 Acacetin。为此,异源生物合成途径被分为不同的模块,每个模块都容纳在专用的大肠杆菌菌株中进行功能表达。在优化组成菌株之间的接种率后,与单一培养对照相比,工程共培养物的产量提高了4.83倍,在摇瓶中培养三株共培养物会在48小时后产生20.3 mgL−1Acacetin。
主要内容:
1.双菌株共培养设计
构建了两个大肠杆菌菌株PU1和BD1,分别包含上游和下游通路模块,并在一个合并培养物中共培养,上游模块包含工程化的酪氨酸途径和酪氨酸氨裂解酶TAL,用于将葡萄糖转化为p-Coumaric acid。下游模块包含一系列异源酶,包括4CL、CHS、CHI、MatB、MatC、FNSI和PaCOMT,用于将p-Coumaric acid转化为Acacetin。上游和下游菌株之间的接种比例从1:1到1:19不等,以平衡相应通路模块的生物合成能力。
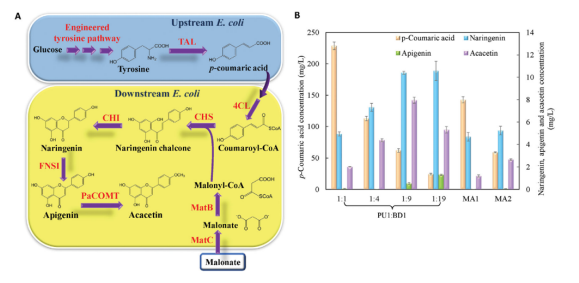
图1 A:双菌株系统模式图 B:PU1:BD1不同接种比例下中间产物和终产物的含量变化
上游菌株PU1的高接种百分比有利于途径中间体p-Coumaric acid的提供,但它抑制了下游菌株的亚群和生物转化能力。结果,观察到相对高的p-Coumaric acid积累。另一方面,下游菌株BD1的高接种百分比对两个途径模块的相对生物合成强度产生相反的影响。基于这两种效应,在1:9的比例下,Acacetin的最佳产量7.9 mgL-1,相应的p-Coumaric acid积累量为62.0 mgL-1。通过将整个 Acacetin途径分别引入上游和下游共培养菌株,构建了两个单一培养对照菌株MA1和MA2。结果发现,在相同的培养条件下,MA1和MA2仅分别产生 1.2和2.7 mgL-1Acacetin。单一培养对照和共培养之间的生产差异清楚地证明了模块化共培养工程对天然产物生物合成的能力。
另一方面,Naringenin和Apigenin的积累远低于p-Coumaric acid。在1:9的最佳接种比例下,仅检测到10.4 mgL-1Naringenin和0.5 mgL-1Apigenin。该结果表明Naringenin和Apigenin的供应不足限制了共培养系统中Acacetin的生产。对于双菌株共培养,与Naringenin和Apigenin生物合成相关的酶促反应都被纳入下游菌株,这对菌株造成了过度压力,并消除了平衡柚皮素提供和转化需求的灵活性。
2.三菌株共培养体系
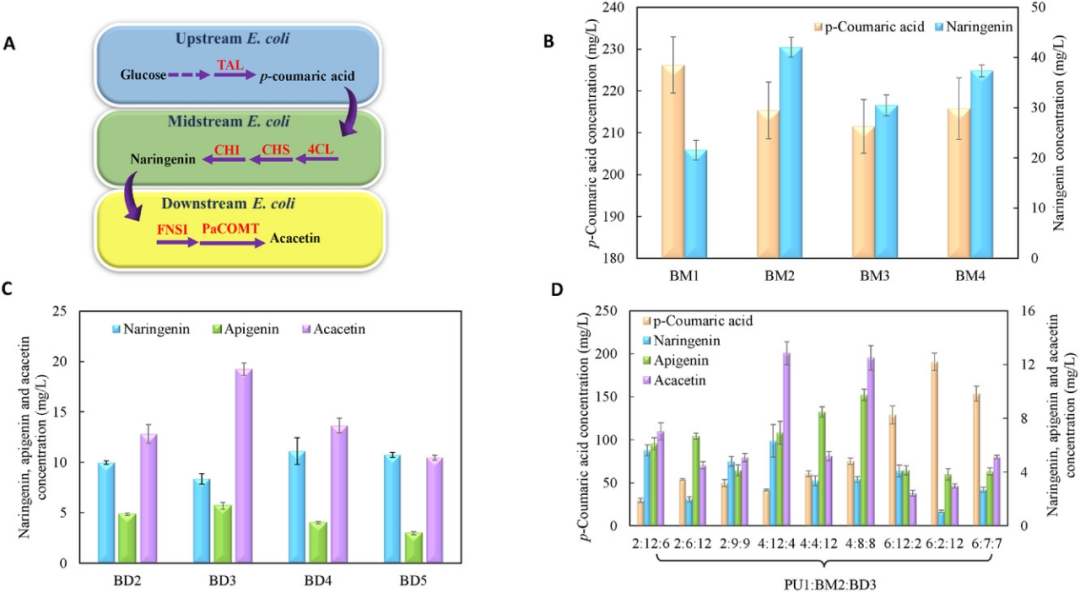
图2
A)三菌株系统模式图
B)四种候选中游菌株生产能力
C)四种候选下游菌株的生产能力
D)最终三菌株系统在不同接种比例下中间产物和终产物的含量变化
在该系统中,上游菌株负责途径中间体p-Coumaric acid的形成,而中游菌株被设计用于生产 Naringenin。共培养的下游菌株专用于从Naringenin生产Acacetin的最后两个酶促步骤。
三菌株设计进一步分散了中游和下游菌株之间与p-Coumaric acid到Acacetin转化相关的代谢负担,还提供了一个平台,可以更精细地平衡Naringenin 提供和转化途径模块之间的生物合成能力。为此,首先着手确定合适的菌株以分别适应中游和下游通路模块。对于中游菌株,低丙二酰辅酶A可用性是高效Naringenin生产的限制因素。在双菌株共培养系统中,引入了重组丙二酸同化途径(MatB和 MatC),将外源丙二酸转化为丙二酰辅酶A。
最近的一项研究表明,过表达脂肪酸合酶FabF会增加细胞内丙二酰辅酶A水平。因此构建了四种候选中游菌株,并通过p-Coumaric acid补料实验比较了它们的生物转化能力。不含MatBC或FabF过表达的菌株BM1产生21.5 mgL-1柚皮素。仅过表达MatBC并补充2 gL-1丙二酸的菌株BM2产生42.0 mgL-1柚皮素,比BM1对照高1.95倍。单独过表达FabF(BM3) 或与MatBC(BM4)一起过表达的产量低于BM2,尽管其确切原因尚不清楚。
因此,选择BM2作为三株共培养工程中的中游菌株。同样,对于下游菌株选择,构建了四个菌株,即BD2、BD3、BD4和BD5,并通过Narigenin补料实验比较了它们将Naringenin转化为Acacetin的能力。值得注意的是,这些菌株被设计为具有不同的FNSI和PaCOMT表达强度,用于Acacetin生物合成。如图2 C所示,分别从两个T7启动子表达FNSI和PaCOMT的菌株BD3显示出最高的19.2 mgL-1金合欢素产量,因此被选为三菌株共培养的下游菌株。
使用上面确定的菌株,建立了PU1:BM2:BD3共培养物,用于从葡萄糖生物生产Acacetin。对于接种率优化,首先将上游菌株的接种率分别设置为10%、20%和30%。然后相应地改变第二个和第三个菌株之间的比率以平衡整个途径。三株共培养的金合欢素生物生产如图2 D所示。当上游菌株接种比例为30%(6:12:2、6:2:12、6:7:7)时,相应途径的中间体对香豆酸产生过量,但中游和下游菌株的亚群大小和相关的生物合成强度相对较小。导致Acacetin 产量低。
另一方面,过低的上游菌株接种比例(2:12:6、2:6:12、2:9:9)导致p-Coumaric acid的供应减少,这也导致了次优的Acacetin生产。当上游菌株以20%(4:12:4、4:4:12、4:8:8)接种时,观察到高Acacetin产量。在4:12:4的接种比例下实现了12.8 mgL-1Acacetin的最佳产量,在4:8:8时实现了12.5 mgL-1的类似产量。三菌株共培养的最高产量比单一培养对照的最佳产量高4.83倍,比双菌株共培养高1.62倍。因此表明,可以通过合理控制接种比例来优化生物合成来解决三个途径模块之间生物合成强度的不平衡。
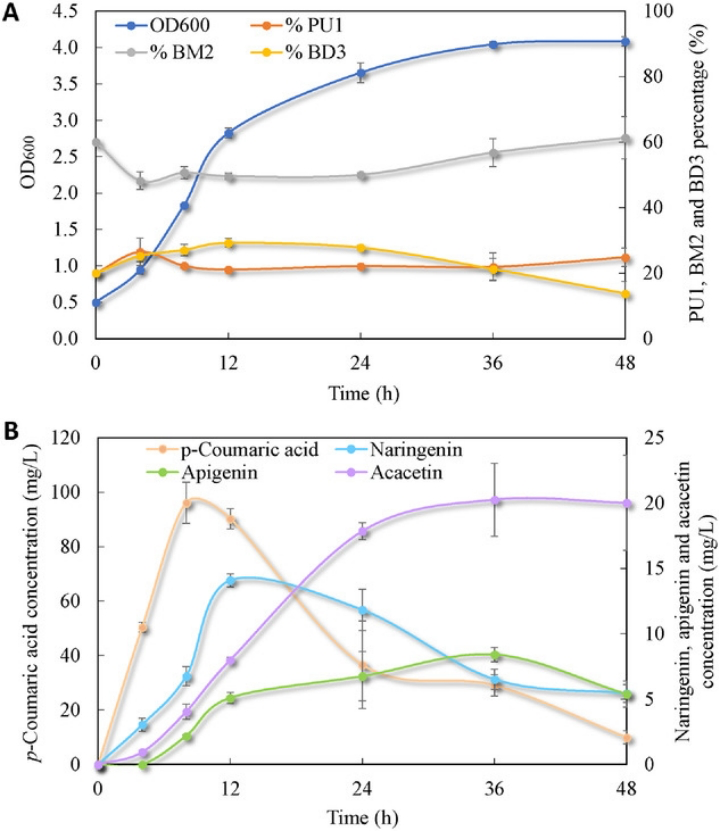
图3 摇瓶培养过程中的生长和生物合成行为
A) 共培养细胞密度和三种菌株个体亚群百分比随时间的变
B) p-Coumaric acid、Narigenin、Apigenin和Acacetin 浓度随时间的变化
PU1:BM2:BD3共培养物以4:12:4的比例接种
三、摇瓶中的三菌株共培养生物生产
为了进一步研究生长相容性和整体生物合成性能,通过在10 gL−1葡萄糖上培养PU1:BM2:BD3进一步分析了三菌株共培养生长和生物合成的动态接种比例为4:12:4的摇瓶中。如图3所示,共培养的细胞密度随着时间的推移而发展,并在24小时后稳定下来。4小时后,上游菌株PU1的百分比从20%变为 25%,并在剩余培养期间稳定在21%左右。
中游菌株BM2的种群大小在4小时后从60%下降到48%,直到24小时保持稳定,并在培养结束时逐渐增加到 61%。对于下游菌株BD3,亚群在前12小时内从20%增加到29%,然后随着时间的推移下降到培养结束时的14%。三种菌株的生长趋势表明,中游菌株BM2在进入稳定期之前的生长比其他两种菌株慢,这主要是由于与该菌株中过度表达异源酶相关的代谢负担。
尽管如此,共培养的菌构成总体上仅在相对较小的范围内波动。对p-Coumaric acid、Narigenin、Apigenin和Acacetin的浓度分布如图3 B所示。结果发现,中间体p-Coumaric acid的积累在8小时内迅速达到96.2 mgL-1,然后逐渐下降至10 mL-1左右,Narigenin、Apigenin的积累分别在12和36小时达到峰值。最终产物Acacetin的浓度在前24小时内迅速增加,表明Acacetin的生物合成发生在指数期和早期稳定期。在36小时达到20.3 mgL-1的最高Acacetin浓度,这明显高于使用图2 D所示的培养管在5 gL-1葡萄糖上的产量。
个人评价:
该研究并未调控共培养中的菌体系的比例,但是最终培养后菌构成比例区域稳定并在小范围内波动,且通过将代谢通路拆分给三种菌从头生产Acacetin 提高了产量。