文献标题:
Bacterial cellulosehyaluronic acid nanocomposites production throughco-culturing Gluconacetobacter hansenii and Lactococcus lactis in a two-vesselcirculating syste
DOI号:
10.1016/j.biortech.2019.121715
关键词:
Bacterial cellulose,Hyaluronic acid,Co-cult,uring Lactococcus lactis,Bioreactor
内容摘要:
通过在设计双容器循环中共培养汉森氏葡萄糖酸菌(Gluconacetobacterhansenii,以下简称G.hansenii)以及乳酸菌(Lactococcus lactis,以下简称L.lactis),实现细菌纤维素(bacterial cellulose,以下简称BC)与透明质酸(Hyaluronic acid,以下简称HA)的交联,制造出拥有更良好物理性能的BC/HA复合材料。
主要内容:
1.前言
由2022BNUZH的课题,他们使用壳聚糖和HA对生产出来的BC进行修饰,以增强BC的物理和机械性能。经组会讨论,考虑到壳聚糖对大肠杆菌而言是有毒性的,因此我将目光转向HA。HA就是在护肤品中的玻尿酸的别名,其保水能力是广为人知的。由于我们计划生产BC是作为保水剂使用,因此使用 HA修饰BC,一方面能够提升BC的物理和机械性能(尤其提升BC的保水性能),一方面又能够实现生产双保水剂,可谓一箭双雕。
不过,BC如何与HA交联是一个问题,目前常用手段是将已经纯化的HA加入到BC中,然后通过添加化学药剂,促进HA与BC的交联,最终得到一个BC/HA的网状结构。这个存在的问题是,额外添加HA,会有成本过高的问题,这与我们想要生产低成本保水剂的初衷背道而驰。同时,使用化学药剂促进交联工序繁琐,不适合应用在我们的生物工厂中。因此,这篇文献中提到的共培养、自主交联的办法,就很符合我们的设想。通过阅读文献,希望能够发现可以应用在我们设计中的部分,实现我们的设想。
2.BC与HA
细菌纤维素(BC)因其高纯度、生物相容性和优异的机械性能而引起了研究人员的兴趣。基于BC的纳米复合材料是一个很有前景的研究课题,目前广泛研究的复合材料包括BC/海藻酸盐BC/胶原蛋白/羟基磷灰石、BC/壳聚糖、肝素化BC、甘露糖化BC、BC/聚苯胺、BC/普鲁兰多糖和BC/木葡聚糖。这些BC 的纳米复合材料已应用于生物医学领域,在改善生物相容性、细胞附着和成纤维细胞生长到人造血管、伤口敷料和组织再生方面都有应用。
透明质酸(HA),又称玻尿酸,是一种线性多糖,由 D-葡萄糖醛酸(D-glucuronicacid)和N-乙酰基-D-氨基葡萄糖(N-acetyl-D-glucosamine)的双糖重复单元组成,对细胞生长、增殖和伤口愈合具有有益作用。BC/HA纳米复合材料是通过在BC的生物合成过程中在培养基中添加纯化的HA,或将BC薄膜浸入HA溶液中制备的。不过,由于市场上HA的价格十分昂贵,额外添加HA会导致生产BC/HA复合材料的成本显著升高。
生物技术中广泛使用的方法——共培养发酵,为这里生产BC/HA成本高的问题提供了良方。通过在适当培养条件下共培养G.hansenii和L.lactis,发酵过程中可直接形成BC/HA纳米复合材料。
3.共培养方法
3.1激动状态和静止状态
通常,培养生产BC的细菌时,根据培养方法可分为两个大方向——激动状态和静止状态。在搅拌培养基中,溶解氧(DO)和pH值可以在必要时进行监测和调整。还可以提供葡萄糖等其他营养物质并充分混合以支持菌株的生长。同时根据搅拌方法的不同,合成的细菌纤维素的形状可以是多种形式,包括多形浆状物、纤维状物和椭圆形颗粒状物。
静态条件下,BC在空气和介质界面产生,形成凝胶状薄膜。这些BC薄膜有更大的内表面积,保持着规则的形状和完整的三维结构,因此有更好的机械强度和保水性能。也就是说,动态培养下生产的BC机械性能略逊于静态培养下生产的BC。但是,在静态培养基中,只能调整有少数参数,包括温度、pH 初始值和不同营养素的初始浓度,其可控性不如动态培养。
文献使用的是静态培养和动态培养的结合方法,这是通过他们自己设计的装置来完成的。不过,考虑到我们的保水剂不需要那么精细的结构,以及调配溶液与排放保水剂时难易度,综合考虑下来,我认为我们的设计中应该使用动态培养法,更易于操控,后处理也比较容易。
3.2 共培养方法
这是在他们双容器循环装置中完成的(详细设计见下项)。
3.2.1 菌株与培养基的准备
1.G.hansenii ATCC 23769来自美国类型培养集(ATCC)。
2.L.lactis APJ3是Chauhan等人用乳酸菌MG1363 和来自Bioneer(丹麦)的质粒pAMJ399构建。
3.配置标准Hestrin-Schramm(HS)培养基。混合 20.0 g/L葡萄糖、5.0 g/L细菌蛋白胨(bacterial peptone)、5.0 g/L酵母提取物、2.7 g/L磷酸钠二盐 基、1.15 g/L柠檬酸和1.0 g/L硫酸镁,然后用盐酸调节pH值至5.0。
4.配置HS琼脂培养基。在标准HS培养基中加入1.5%(w/v)琼脂和红霉素(Sigma-Aldrich),最终浓度为2 μg/mL。
5.配置改良的M17培养基。混合30 g/L的葡萄糖,2.5 g/L的酪蛋白胨(casein tryptone),2.5 g/L的细菌蛋白胨,5 g/L的大豆蛋白胨,2.5 g/L酵母提取 物,5 g/L牛肉提取物,0.5 g/L抗坏血酸,0.22 g/L硫酸镁,19.1g/Lβ-甘油磷酸钠,3.5g/L柠檬酸,8.97g/L磷酸二钠。
6.配置葡萄糖溶液533 g/L、267 g/L和133 g/L。
7.上步葡萄糖溶液将在共培养时,分别以0.067 g/h、0.033 g/h和0.017 g/h的速度不断加入到发酵系统中。(这里设计的进料速率是依据HA的最佳配比:0.5%、0.2%、0.1%至0.05%(w/v)计算得来)
3.2 具体培养方法
1.在接种共培养时,G.hansenii和L.lactis之间的菌落形成单位(CFU)设定为1:1。
2.对于G.hansenii,将10 mLHS培养基、34 µL解冻的冷冻原液和34 µL纤维素酶(Sigma-Aldrich)混合并在30°C和250 rpm下摇动,直到600 nm波长下的光密度(OD)达到0.90(7.2±3.4×107 CFU/mL)。
3.通过用等体积的新鲜HS培养基清洗菌株三次,去除培养基中的纤维素酶。
4.离心4500×g,4℃,5min,收集菌株。
5. 对于L.lactis,首先将其解冻的冷冻原液接种到含有2µg/mL红霉素的HS琼脂平板上,以选择含有转移质粒的菌株。
6. 将平板放在30℃的培养箱中24至36小时。挑选在琼脂平板上形成的菌落,接种到5 mL含有2 μg/mL 红霉素的新鲜HS培养基中,在30 ℃和250 rpm下培养过夜。
7. 将另外10 mL含有2 µg/mL红霉素的新鲜HS培养基接种到1%(v/v)的过夜培养基中,并在30℃和250 rpm下摇动,直到OD600nm的值达到0.66,此时菌株处于早期对数阶段(3.4±0.2×107 CFU/mL)
8.当开始共培养时,将1 mLG.hansenii的原代培养物和1 mLL.lactis的原代培养物接种到每100 mL改良的M17培养基中,其中还含有2 μg/mL红霉素。
9.在30 ℃下运行双容器循环系统7天后,收集纤维素小球并在80 ℃下用0.1 M NaOH溶液清洗1hr。
10.碱处理重复一次,然后用去离子(DI)水冲洗,直到达到pH7.0。
11.纯化的纤维素被冷冻干燥(Freezoom2.5 L, Labconco),精确称重(AE240,Mettler Toledo),并储存在干燥器中,以便进一步分析。
12.G.hansenii和L.lactis共培养产生的纤维素被标记为Co BC,而来自G.hansenii单培养的纤维素,作为对照组,被标记为23769 BC。
13.在相同的条件下,同时进行乳酸菌APJ3的单培养,作纯HA的对照。
4. 仪器设计
文献中记述了一种双容器循环系统的设计。这个系统允许G.hansenii在空气—液体界面生产纤维素薄膜,同时为共培养菌株L.lactis提供氧气和葡萄糖,使其能够生长和生产HA。系统包含的部件如下:
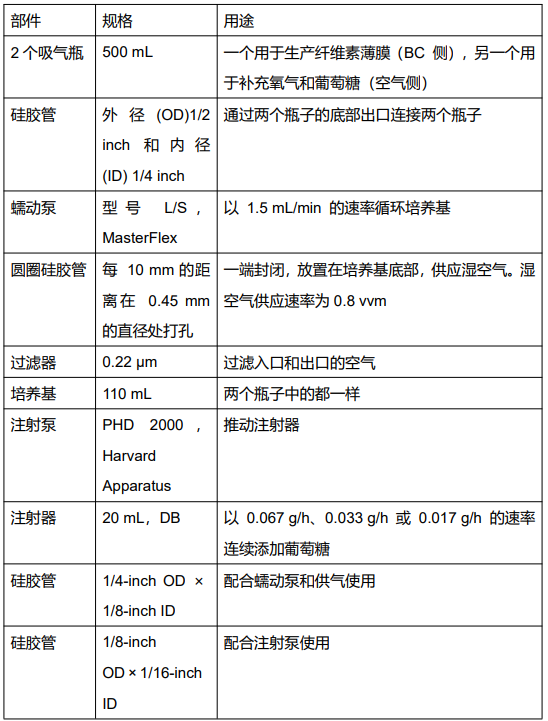
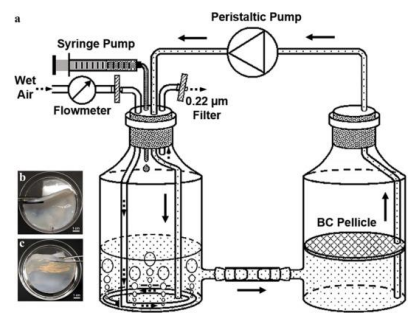
图1 双容器循环系统
系统使用时,湿空气和葡萄糖被供应到空气侧(左边的容器),通过剧烈的气泡混合,最后在培养基中循环分布。BC在BC侧(右侧容器)的空气和液体的界面上生长。黑色箭头表示培养基的流动方向。虚线箭头表示湿空气的流动方向。
*备注:虽然蠕动泵在两个吸液瓶之间循环培养基,但在BC侧容器中保持相对静止的状态,并且在气液界面合成了BC薄膜。
5. 物理性质测试结果
5.1 X 射线衍射
研究人员通过X射线衍射测试了Co BC的晶体信息。结果表明,Co BC的晶体尺寸比23769 BC大。研究人员猜测,是因为HA通过使微纤维紧密靠近,促进共结晶,从而形成更大的晶体。同时作为线性聚合物的HA也可以沿微纤维的长度以线性方式结合,从而使微纤维紧密排列,同时促进共结晶。
5.2 FESEM 图像
23769 BC和Co BC的表面形貌通过FESEM图像呈现。作为对照样品的23769 BC表现出多孔纤维素网络,而与23769 BC相比,在Co BC样品中
观察到具有更小孔径和更大条带的更密集网络。同时,他们也观察到,随着葡萄糖的恒定进料速率从0.067 g/h降低到0.033 g/h或0.017 g/h,共培养的乳酸乳球菌合成的HA下降,Co BC中的孔径呈增大趋势。
5.3失重分析研究
通过失重分析研究了Co BC的持水能力。在所有葡萄糖进料速率下的23769BC样品在60分钟后几乎完全干燥。当HA随着浓度的增加而整合时,Co BC需要更长的时间才能完全干燥。研究发现,在0.067 g/h组下生产的Co BC显示出最长的时间,即需要120分钟才能失去所有的水。与23769 BC相比,Co BC增强的持水能力可能与HA的保水性能和这些纳米复合材料中更小的孔径的组合有关。
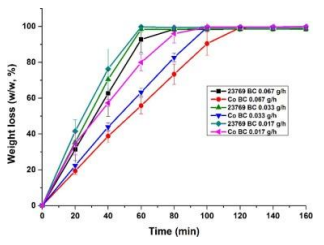
图2 23769 BC和Co BC在0.067 g/h、0.033g/h和0.017g/h的恒定葡萄糖进料速率下的重量损失分析(n=3)
个人评价:
总的来说,共培养生成BC/HA自主交联的纳米复合材料,相比纯BC,有着晶粒更大、网间孔径更小、保水性能更好的优点。这就完全符合我们想对BC修饰的初衷,换而言之,HA 也完全符合我们对修饰物的要求与期许。因此可以考虑应用HA到我们的设计中。
根据文献中记述,BC/HA的HA含量在0.5%、0.2%、0.1%至0.05%(w/v)范围内,已有很好的医疗效果(保水、修护等),尤其以0.1%和0.05%HA最佳。因此我推测,在我们计划合成的保水剂BC/HA 中,HA作为修饰和辅助也无需过量。因此配合大肠杆菌生产HA,就无需再增加它的产量,只要能合成
就行,这就大大降低我们的工作难度。
并且,在实际应用阶段,我们无需再对BC/HA进行表征,则实验操作中洗脱和纯化的部分可以省略。共培养数天(时间缩短还需要再测试)后,直接将培养出的产物加水,配制溶液,就可以投放,这就简化了我们的工作流程。
最后,这个共培养装置也很适合应用在我们设计的生物工厂中。诸多细节还需待定,但大体方向已经非常明确。