合成生物学新突破:细菌同步裂解实现体内高效药物递送
大家是不是都认为:细菌往往和疾病挂钩呢?
但你知道吗?其实有些细菌能成为对抗疾病的 “秘密武器”。
一篇发表在Nature的文献——Synchronized cycles of bacterial lysis for in vivo delivery,就揭示了细菌在医学领域的神奇新用途。

01、研究背景:细菌的双面性与治疗新契机
曾经,人们觉得细菌都是有害的,然而越来越多科学家发现:人体内不少细菌是有益的。不仅如此,一些细菌还会在疾病环境里生长,这就给开发新型疗法带来了灵感:
能不能利用这些细菌,让它们在限制自身生长的同时,还能持续释放治疗物质呢?
基于这个想法,研究人员展开了一系列探索。
02、研究思路:构建同步裂解电路实现精准药物递送
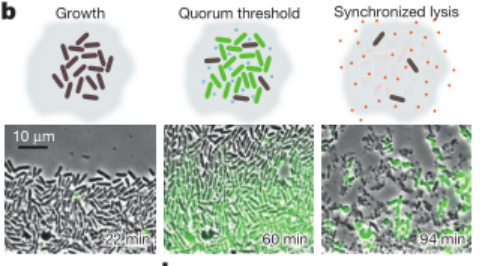
为了达成这个目标,研究团队利用合成生物学技术,构建了一个同步裂解电路(SLC)。这个电路就像给细菌设定了一个 “定时炸弹”,当细菌数量达到一定阈值时,就会同步裂解,释放出携带的 “货物”,而且裂解后少量存活的细菌还能重新繁殖,形成脉动式的递送循环。
具体来说,SLC 利用了正负反馈回路。正反馈是通过 luxI 启动子调节自诱导物(AHL)的产生,AHL 和 LuxR 结合后,能激活启动子;负反馈则是由噬菌体裂解基因(ϕX174 E)引发细胞死亡,这个基因也受 luxI 启动子控制。AHL 可以扩散到周围细胞,起到细胞间同步的作用。
SLC示意图
工程菌周期性释放药物
03、研究成果:多维度验证 SLC 的有效性
1. 体外实验:微流控装置见证细菌的神奇表现
o 研究人员借助微流控装置,用 sfGFP 作为指示分子,观察到细菌呈现周期性裂解,裂解事件和 sfGFP 荧光峰值对应,而且不同周期裂解细胞的比例比较稳定。
o 为了测试 SLC 在不同环境下的稳定性,研究人员改变了温度和灌注速率,发现 SLC 在这些条件变化时,仍能保持约 3 小时的平均裂解周期,这表明它在体内复杂环境中也可能稳定工作。
o 在 SLC 菌株中加入编码溶血素 E(HlyE)的基因后,体外共培养实验显示,当携带 SLC 电路的鼠伤寒沙门氏菌裂解时,共培养的 HeLa 细胞会死亡,这证明 SLC 细菌能释放足够的 HlyE 杀死肿瘤细胞。
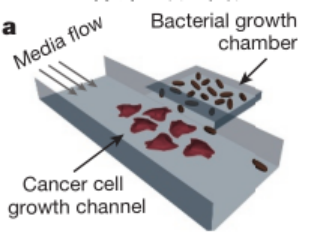
设计出的微控流装置
2. 体内实验:SLC 在小鼠模型中的卓越成效
o 研究人员给小鼠皮下接种结直肠肿瘤,瘤内注射 SLC 细菌后,利用体内成像技术观察到肿瘤内细菌呈现脉动式群体动态,而且细菌发光强度比未修饰菌株低两个数量级,这说明 SLC 细菌能有效控制自身在肿瘤内的数量。
o 研究人员构建了多种携带不同有效载荷的 SLC 菌株,比如能激活免疫反应的(通过招募 T 细胞和树突状细胞),还有能诱导肿瘤细胞凋亡的。实验发现,免疫招募菌株对肿瘤生长的抑制效果最强,而且三种菌株混合(SLC - 3)的效果比单一菌株更好。
将 SLC - 3 菌株和临床化疗药物 5 - 氟尿嘧啶(5 - FU)联合用于小鼠肝结直肠转移模型。结果显示,联合治疗显著降低了肿瘤活性,延长了动物存活时间,效果比单一疗法好很多。
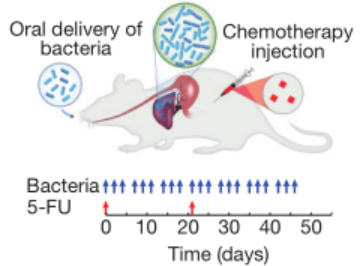
口服细菌在肝结直肠转移实验模型中的体内测试
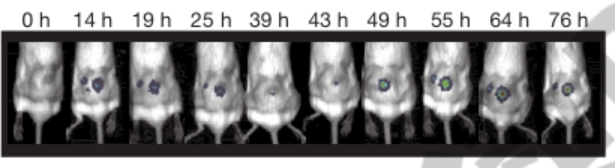
工程菌在小鼠体内发光
3. 数据分析:全方位评估 SLC 的优势
o 通过计算模型发现,反馈控制蛋白的高生产和降解速率能扩大振荡动力学的参数范围,而且在 LuxI 蛋白上添加 ssrA 降解标签序列,能调整裂解周期和菌落激发幅度,让 SLC 的递送特性更符合实际需求。
o 体内实验数据表明,SLC - 3 菌株治疗组的肿瘤细胞凋亡水平更高,而且静脉注射 SLC 菌株比未修饰菌株更能让小鼠受益,初步证明 SLC 设计能减轻细菌注射对宿主的负担。
04、研究意义与展望
这项研究意义重大,SLC 为利用合成生物学开发细菌疗法提供了新方法。和传统药物递送策略相比,它不需要预先加载药物或额外构建分泌机制,还能通过控制细菌群体数量,降低全身炎症反应的风险。
未来,通过调节群体周期的频率和幅度,SLC 有望发展出更多新型细菌药物递送策略,在体内环境中构建更有效的治疗体系。但目前也面临一些挑战,比如如何保证电路长期稳定,以及寻找更多有效的治疗载荷。相信随着研究的深入,这些问题都能得到解决,为人类健康带来更多希望。